Işın tedavisi, şua tedavisi ve radyasyon tedavisi olarak da adlandırılan radyoterapi (RT), kanseri tedavi etmek için ilk olarak bundan yaklaşık 1 asır önce kullanılmıştır. O zamandan bu yana bu yöntemin etkinliğini artırmak ve yan etkileri en aza indirmek için teknolojik olarak büyük ilerleme kaydedilmiştir.
Giderek daha yaygın bir şekilde radyoterapi, tümör kontrolünü ve yaşam kalitesini artırmak ve yan etkileri azaltmak için, cerrahi ve sistemik tedavilerle birlikte kullanılmaktadır. En iyi tedavi sonuçlarına her bir hasta multi-disipliner bir kanser tedavi ekibi tarafından değerlendirilerek ulaşılır. Bu ekipte radyasyon onkoloğu, medikal onkolog, cerrah ve diğer uzmanlar bulunur.
Radyoterapinin birçok farklı uygulama şekli ve amacı vardır:
- tek tedavi olarak,
- sistemik ajanlarla birlikte,
- ameliyattan önce veya sonra, mikroskobik boyutta tümör kalma iltimalini minimanize etmek için,
- hastalık ileri evrede olduğunda destek amaçlı
Tedavi süresi tek seanstan, 8 haftalık günlük uygulamaya kadar değişebilir. Her bir farklı hasta için teknik, doz, beklenen faydalar ve yan etkiler tanıya ve tedavi bölgesine göre değişebilir.
Tümör dışındaki sağlıklı organların korunması onkolojinin önemli konularından biri haline gelmiştir (organ koruyucu tedaviler). Meme ve gırtlak kanseri gibi belli kanser türlerinde tüm organın çıkarıldığı radikal ameliyatlar yerine, sadece tümörün çevresinde bir miktar normal doku ile birlikte çıkarıldığı ve takibinde adjuvan (koruyucu) radyoterapinin uygulandığı hastaların uzun dönem sonuçları birbirine denktir. Hatta beklendiği üzere organ koruyucu işlemler daha az yan etki sunmaktadır.
Radyoterapi nasıl etki eder?
Klinisyen tarafından özgül olarak belli bir alanın hedeflendiği bu tedavi yönteminde kanserli hücreleri öldürmek için radyasyon enerjisi kullanılır.
Radyoterapi, atomları iyonize etme yoluyla kanser hücrelerinin DNA'sına hasar verir (DNA çift sarmalında kırılmalar).
Tedavi verilen alanda hem kanserli hem de normal hücreler radyasyonun iyonize edici etkisine maruz kalır. Fakat normal hücreler radyasyona bağlı oluşan DNA hasarını tespit ve tamir etmede daha hızlıdır. Kanserli hücreler ise çoğalma odaklıdır, büyüme ve çoğalmada daha hızlıdır ve bu nedenle DNA hasarlarını tamir etmede normal hücrelere göre dezavantajları vardır. Bununla birlikte normal dokuların radyasyona dayanabilecekleri maksimum total doz limitleri vardır. Burada denge iyi ayarlanmalıdır. Radyasyonun total dozunun günlük küçük dozlara bölünmesi (fraksiyon), normal dokuların kendilerini tamir etmesine olanak verir.
Radyoterapi teknikleri 3 ana başlıkta incelenir:
- Eksternal (dıştan) radyoterapi
- Brakiterapi (içten radyoterapi)
- İntraopetarif (ameliyat sırasında) radyoterapi
Eksternal (dıştan) radyoterapi
En sık uygulanan radyoterapi yöntemidir. Hastanın dışında bulunan bir radyasyon kaynağı (eksternal beam) kullanılır.
İyonize edici radyasyon üretmek için elektron veya proton gibi yüklü parçacıkların hızlandırılması veya Kobalt-60 kullanılır. Lineer hızlandırıcı: bu cihazda elektronlar daha yüksek enerjiye ulaşmaları ve X-ışını (fotonlar olarak da bilirnir) halini almaları için hızlandırılır. Çeşitli enerjilerde foton veya elektron ışınları üretebilir, ve bunların çıkışı gelişmiş bilgisayar kontrolleri ile yönetilmektedir.
Fotonlara karşı elektronlar: fotonlar daha derin dokulara ulaşabilir ve iç organların kanserlerinde tercih edilir. Elektronlar sıklıkla meme ve cilt kanserleri gibi yüzeysel tümörlerde tercih edilir, böylelikle iç organların hasar almasının da önüne geçilir. Sıklıkla fotonlar ve elektronlar en iyi tümör ve normal doku doz dağılımına erişmek için kombine edilirler.
Tedavi planlaması:
Tedavi planı;
- hastanın dikkatli bir şekilde sabitlenmesini,
- radyasyon uygulanacak alanın bilgisayarlı tomografi (BT) veya manyetik rezonans görüntüleme (MRG=emar) gibi radyolojik yöntemler ile belirlenmesini, ve
- doz ve uygulama sıklığının hesaplanmasını içerir.
Farklı tümörlerin radyoterapi duyarlılıkları da farklıdır. Örneğin, lenfoma ve bir testis kanseri çeşidi olan seminom radyoterapiye son derece duyarlı (radyosensitif) ve radyoterapi ile tamamen tedavi edilebilecek kanser türleri iken; cilt kanseri malign melanom ve yumuşak doku sarkomları radyoterapiye dirençlidir (radyorezistant) ve bu tümörlere etki etmek için daha yüksek doz ışına ihtiyaç duyulur.
Konformal terapi
Bu terim, tümör alanına yüksek doz, normal dokulara ise olabildiğince az ışın verilmesi stratejisini tanımlamak için kullanılmaktadır. BT ve MRG gibi ileri görüntüleme yöntemleri kullanılarak 3-boyutlu konformal RT (3D-CRT) ile radyasyon onkologları tümörün ve komşu normal dokuların alacakları ışın dozunu ayrı ayrı hesaplayıp ayarlama yapabilirler. Böylelikle yan etkiler en aza indirilmiş olur. Ayrıca, ışınlanmış bir alanın daha sonra gereklilik halinde tekrar ışınlanmasına da olanak verir.
3D-CRT uygulamaları iki başlıkta incelenir:
- Yoğunluk ayarlı RT (intensity modulated RT=IMRT)
- Görüntüleme kılavuzluğunda RT (image guided RT=IGRT)
Yoğunluk ayarlı Radyoterapi (IMRT)
3 boyutlu konformal radyoterapinin gelişmiş bir formu olan IMRT, tek kaynaktan çıkan radyasyon ışınının, hedefin farklı bölgelerine farklı şiddette uygulanmasına olanak verir.
Görüntüleme kılavuzluğunda radyoterapi (IGRT)
Yüksek yoğunlukta ışınlanması gereken alanın ne olması gerektiği radyasyon onkolojisi pratiğinde tartışılan bir konudur. Ayrıca nefes alıp verme sırasında organların az da olsa yer değiştirmesi göz önünde bulundurulmaktadır.
Her bir tedavi sırasında gerçek zamanlı görüntüleme hedefin daha iyi belirlenmesine olanak verir. Radyoterapide bu teknolojiler genel olarak görüntüleme kılavuzluğunda radyoterapi (IGRT) olarak adlandırılır.
Proton tedavisi
Dıştan radyoterapinin özel bir formu olan proton tedavisi ile yapılan ışınlama, ağır partiküllerin kendilerine has fiziksel özelliklerinden ötürü normal dokular daha az zarar ve tümörlü alana daha hassas bir radyoterapiye olanak verir. Protonlar farklı derinliklerdeki dokulara nüfuz edebilir; hedef dokuya ulaştığında da enerjilerini keskin bir şekilde salar, buna Bragg piki denir.
Birçok kanser türünde protonların fotonlara bir üstünlüğü olup olmadığı araştırılmakla birlikte, bazı çocuk çağı kanserleri, uveal melanom vb. hastalık grubu dışında üstünlük gösterilememiştir. Özellikle prostat kanserinde yoğun olarak denenen proton tedavisi sonuçları, 3-boyutlu konformal tekniklerle denk bulunmuştur.
Sterotaktik radyoterapi teknikleri (SBRT ve radyocerrahi SRS)
Toplam hesaplanan radyasyon dozunun tek veya birkaç seferde (fraksiyon) uygulanmasıdır.
Sterotaktik radyocerrahi (stereotactic radiosurgery = SRS) beyin tümörlerinde; sterotaktik vücut radyoterapisi (stereotactic body radiation therapy = SBRT) ise akciğer, omurga veya karaciğer gibi beyin dışı organları ışınlamak için kullanılır.
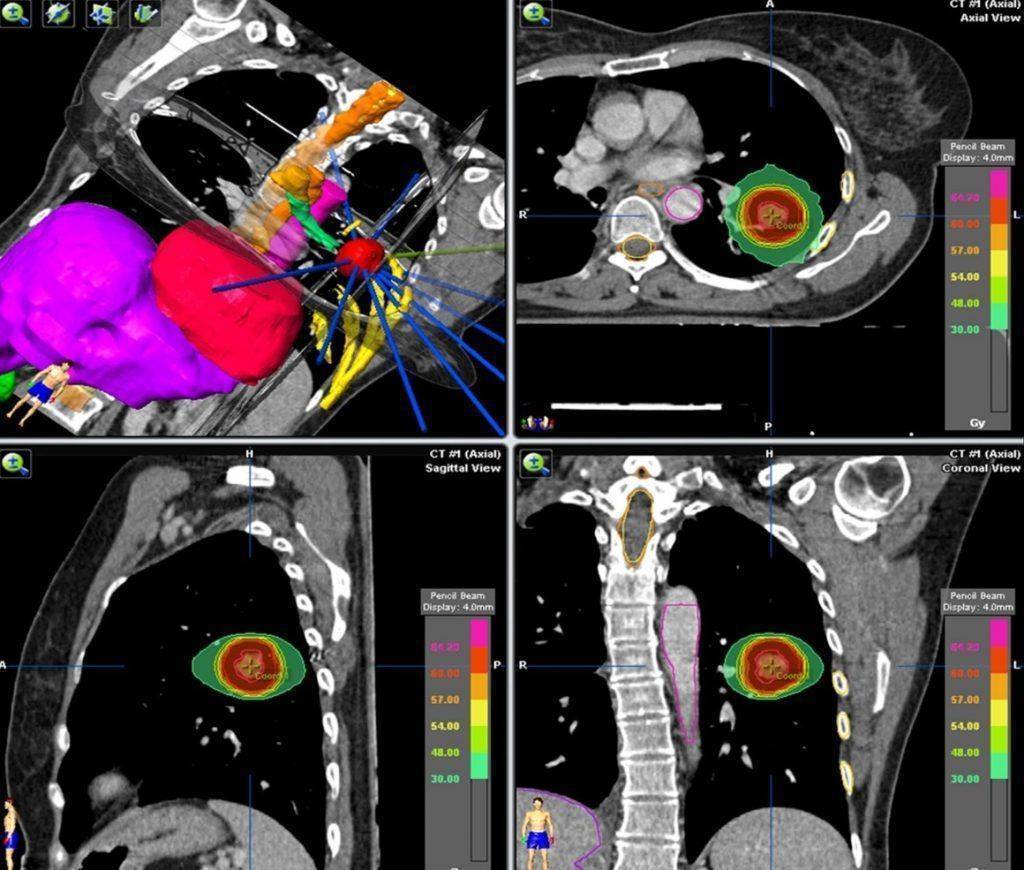
Sol akciğerde erken evre bir akciğer tümörünün SBRT ile tedavisi
Sterotaktik yöntemler için yüksek-çözünürlüklü görüntülemelere ihtiyaç vardır. Özellikle iyi tanımlanmış küçük tümörlerde (örneğin akciğer kanserinin tek bir omurgaya metastaz yaptığı durumda) tercih edilir.
Belli bir noktaya yüksek dozda radyasyon verildiği için hastanın sabitlenmesi (immobilizasyonu) bu yöntemde daha fazla önem taşır.
Tüm vücut ışınlama
Lösemi ve lenfoma tedavilerinde hastayı hemotopoietik hücre nakline hazırlamak için uygulanan tedavilerin bir parçasıdır.
Tüm vücut ışınlamanın 2 amacı vardır: verici kök hücrelerinin reddini önlemek için bağışıklık sisteminin zayıflatılması (immünsupresyon) ve kanserli hücrelerin temizlenmesi.
Brakiterapi (içten radyoterapi)
Brakiterapide, radyasyon kaynağı tedavi alanının yanına veya içine yerleştirilir. Özellikle prostat kanserlerinde ve rahim ağzı (serviks) kanseri gibi jinekolojik malignitelerde tercih edilir.
Örnek olarak bölgesel (erken evre) prostat kanserinde brakiterapi bir tedavi seçeneği olarak karşımıza çıkmaktadır. Düşük doz oranlı (low dose rate = LDR) sistem tek seferde hastaya uygulanmaktadır. Radyoaktif kaynaklar ultrason eşliğinde prostat bezine kalıcı olarak yerleştirilir. Bu kaynaklardan yavaş radyasyon yayılımı aylar içinde gerçekleşir.
İntraopetarif (ameliyat sırasında) radyoterapi (IORT)
Cerrahi sırasında radyasyon uygulamasıdır. Dıştan radyoterapi uygulamasının normal dokulara zarar verme gibi getirdiği bazı sınırlamalar konusunda avantajları vardır. Ameliyat sırasında tek seans olarak uygulanır ve uygulama dozu o an için görüntülenemeyen yapılar (sinirler, sabit organlar) ile sınırlıdır.
Eğer kanserin bölgesel olarak yineleme ihtimali yüksek ise (cerrahi sınırlarda tümör olduğu ameliyat sırasından alınan patoloji örneği (frozen) ile gösterilirse veya tümör tam olarak çıkarılamamışsa) IORT uygulama kararı ameliyat sırasında alınabilir.
Uygulama alanı çoğunlukla kasık ve karın içi bölgesi kanserleridir. Bununla birlikte, tek doz olarak uygulanan IORT ile yeterli tümör kontrolü çoğunlukla sağlanamaz ve bu tedaviyi dıştan radyoterapinin tamamlaması gerekir.
Radyoterapi olası yan etkileri
Radyoterapi süresince veya sonrasında hastaların deneyimlediği yan etkiler büyük oranda tedavi edilen anatomik bölgeye bağlıdır. Aynı zamanda toplam doz, her bir fraksiyondaki doz, dokuların radyoterapi duyarlılığı gibi faktörlerle ve diğer kanser tedavileriyle (kemoterapi ve cerrahi) de ilişkilidir.
Genel bir kural olarak, radyoterapi süresince dokular şişer. Buna bağlı olarak hedef dokuda ödem görülür. Çoğu akut (ani başlangıçlı) yan etkiler önceden beklenen ve radyoterapinin yapıldığı bölgeyle sınırlıdır. Abdominal (karın) bölgesine radyasyon mide bulantısı ve kusma gibi yan etkilere sebep olur. Baş ve boyun bölgesine yapılan radyoterapiler ağız ve boğaz yaralarına neden olurken, toraksa (gövde) yapılan radyoterapi yemek borusu (özofagus) iltihaplanmasıyla sonuçlanabilmektedir. Bu durumlar sırasıyla disfaji (yutmada güçlük), ağızdan besin alımında azalma ve dehidrasyona (su kaybı) neden olmaktadır. Pelvik (alt karın) bölgesine radyoterapi üriner (idrar yolları) ve bağırsak değişikliklerine yol açmaktadır. Ödem ve dokudaki irritasyon (rahatsızlık) tedavi sonrasında azalmakta, akut yan etkiler büyük oranda kaybolmaktadır.
Radyasyon terapisinin uzun dönem etkisi büyük oranda radyasyona maruz kalan dokudaki fibrosizdir. Bu yan etkiler tedaviden görülen yarar ile dengelenebilir. Radyoterapiye özgü geç toksisiteler radyoterapi uygulanan dokuyla ve radyasyon dozuyla ilgilidir. Örnek olarak;
Yumurtalık ve testisler radyasyona karşı oldukça duyarlıdır, üreme organları radyoterapi sonrası hasar görebilir. Bu sebeple, infertilite (kısırlık) pediatrik ve genç yetişkin kanser hastaları için ciddi bir sorundur.
Kardiyak toksisite (kalp hasarı) meme kanseri, hodgkin lenfoma ve kalp bölgesinin de radyasyondan etkilendiği diğer kanserlerin tedavisinde geç komplikasyon olarak görülmektedir.
İkincil kanserlerin meydana gelmesi ile önceki dönemlerde uygulanan radyoterapi tedavisi arasında ciddi bir ilişki kurulmuştur. Yapılan yüksek katılımlı bir araştırmada, 1973 ile 2002 yılları arasında radyoterapi almış kanser hastalarında ikincil kanser oluşma riski yüzde 8 olarak rapor edilmiştir.
Ancak bu analiz kanser radyasyona maruz kalmayan bir popülasyondaki kanser gelişimi için kontrol edilmemiştir. Bu sebeple, meydana gelen kanserlerin birçoğu radyasyona maruz kalmakla ilişkili olmayabilir. Özellikle pediatrik ve genç yetişkin hastalarda bu konu çok önemli ve kritiktir. İkincil kanserlerin klinik olarak teşhis edilebilir seviyeye gelmesi 10-15 seneyi bulmaktadır.
100 yılı aşkın süredir kanser tedavisinde kullanılan radyoterapinin yan etkileri gayet iyi tanımlanmıştır ve yeni teknolojik cihazların en büyük avantajlarından biri bu yan etkileri minimize etmektir. Deneyimli bir radyasyon onkoloji ekibi, hasta ile yakın iletişim halinde bu olası yan etkilere karşı önlem alabilir ve gelişen yan etkileri etkili bir şekilde tedavi edilebilir.
İleri okuma: Kanser tedavisinde radyoterapinin keşfi
1895 yılının sonlarına doğru Wilhelm Conrad Röntgen elektron tüpüyle çalıştığı sırada tuhaf bir sızıntının varlığını fark etti. Işıyan bu enerji güçlü ve görünmezdi; siyah karton tabakaları delip geçmiş ve odadaki baryum levha üzerinde beyaz, fosforlu bir parıltı oluşturmuştu. Bunun üzerine Röntgen eşinin elini ışın kaynağı ile fotoğraf levhası arasına yerleştirdi. Işınlar elin içerisinden geçerek plaka üzerinde parmak kemikleriyle metal nikah yüzüğünün izini bırakmıştı. Elin iç anatomisi sanki sihirli bir lensin ardından görünmekteydi. Çoğu canlı dokunun içinden geçebilecek kadar güçlü bir enerji ve ışık biçimine X-Işınları adını verdi.
1896’da Röntgen’in X ışınlarını keşfi henüz 1 yılını doldurmadan Chicago’da Tıp eğitimini sürdüren 21 yaşındaki bir öğrenci olan Emil Grubbe; bu ışınları kanser tedavisinde kullanmayı akıl etti. Parlak, maceracı ve inanılmaz ölçüde yaratıcı bir kişiliğe sahip olan Grubbe, Chicago’da vakumlu X-ışınları tüpleri üreten bir fabrikada çalışmış ve kendisi de deneylerinde kullanmak üzere tüpün basit bir versiyonunu inşa etmişti. X ışınlarına maruz çalışan fabrika işçilerinin deri ve tırnaklarının soyulup döküldüğüne tanıklık etmiş biri olarak (kendi ellerinde de aynı nedenle çatlak ve şişlikler vardı), bu “hücre ölümü” mantığını tümörlere de uygulamakta gecikmedi.
29 Mart 1896’da Grubbe, Chicago’nun Halsted Sokağı’nda bulunan bir tüp fabrikasında, meme kanserli yaşlıca bir kadın olan Rose Lee’yi duruma uyarladığı bir X-ışını tüpüyle ışın bombardımanına tabi tuttu. Lee’nin kanseri mastektomi ameliyatından sonra nüksetmiş, tümör de memesi de ağrılı ve kocaman bir kitle haline dönmüştü. Grubbe’a görünmesi ona son çare olarak önerilmişti. Grubbe, memenin geri kalanını örtmeye yarayacak bir şey bulma umuduyla etrafına bir göz gezdirdi, ancak ortalıkta herhangi bir metal levhaya rastlayamayınca Lee’nin göğsünü bir Çin çayı kutusunun dibinde bulduğu metalden folyoya sarıverdi. Kanserli doku böylece aralıksız 18 gün boyunca ışınıma maruz bırakıldı. Tedavi acı verici olsa da bir anlamda başarılıydı. Lee’nin memesindeki tümör önce yaraya dönüştü, sonra sıkılaşarak küçüldü. Bu sonuç, X-ışını tedavisinin tarihindeki belgelenmiş ilk bölgesel yanıtı temsil etmekteydi. Ancak ilk tedavi dönemini izleyen birkaç ayın sonunda Lee’nin başı dönmeye midesi bulanmaya başladı. Kanser omurilik, beyin ve karaciğere yayılmıştı. Lee kısa bir süre içinde hayatını kaybetti. Grubbe, böylece önemli bir gözlemde daha bulunmuştu: X-ışınları kanserin yalnızca bölgesel tedavisinde kullanılabilirdi; yayılım yapmış tümörlere etkisi yok denecek kadar azdı.
Etki geçici olsa da aldığı yanıtla ümitlenen Grubbe, bölgesel tümörleri olan birçok başka hastayı iyileştirmek için X-ışını tedavisinden yararlanmaya başladı. Böylece yeni bir tıp dalı, Radyasyon (ışınım) onkolojisi doğmuş oluyordu. Avrupa ve Amerika’nın çeşitli bölgelerinde kısa sürede röntgen klinikleri mantar gibi bitmeye başladı. 1900’lerin başında ise; yani Röntgen’in keşfi üzerinden henüz on yıl geçmeden, doktorlar kanserin ışınımla tedavi edilebilmesi olasılığı karşısında kendilerinden geçmeye başlamışlardı bile. Curieler’in 1902’de radyumu keşifleri sayesinde, cerrahlar artık tümörleri binlerce kat güçlü enerji püskürmeleriyle ışınlayabiliyorlardı. Bu yeni heyecan dalgasının etkisiyle, yüksek dozlu ışın tedavisi konusunda konferanslar düzenlenmeye, dernekler oluşturulmaya başlandı. Altın teller radyumla doldurulup tümör üzerine doğrudan dikiliyor, böylece bölgesel X-ışını dozu daha da arttırılmış oluyordu. Paralel seyir gösteren vakum tüpü teknolojisi de ilerlemekteydi bu arada. 1950’lerin ortalarında, bu tüplerin çeşitli tipleri kanserli dokulara inanılmaz yüksek dozlarda X ışını enerjisi verebilir duruma gelmişti.
Zaman içerisinde radyasyon onkolojisinde kullanılan teknoloji de gelişti ve daha hassas hale geldi. Tarihin ilk dönemlerinde kullanılan X-ışınlarından sonra yüksek enerjili fotonlar, elektronlar, proton ve nötronlar da kullanılmaya başlandı. Ayrıca bilgisayar ve elektronik alanındaki teknolojik gelişmeler sayesinde de tedavi planlama ve uygulamada mükemmele yakın bir seviyeye ulaşıldı.