Avutometinib ve Defactinib FDA Öncelikli İncelemesi – Düşük Dereceli Seröz Over Kanseri
Düşük dereceli seröz over kanseri (LGSOC, low-grade serous ovarian cancer), nadir fakat dirençli bir yumurtalık kanseri türü olup, tedaviye yanıt oranları düşük ve hastalığın tekrarlama riski yüksektir. KRAS mutasyonu taşıyan hastalar bu alt grupta öne çıkan bir gruptur. Son dönemde Verastem Oncology tarafından geliştirilen avutometinib ve defactinib kombinasyonu, tekrarlayan LGSOC tedavisinde umut verici bir seçenek olarak dikkat çekiyor.
ABD Gıda ve İlaç Dairesi (FDA), KRAS mutasyonu olan, daha önceden en az bir sistemik tedavi almış hastalar için avutometinib ve defactinib kombinasyonunu kapsayan yeni tedavinin ruhsat başvurusunu öncelikli inceleme kapsamına aldı. FDA'nın 30 Haziran 2025'te bu tedaviye onay verip vermeyeceğini bildirmesi bekleniyor.
Kanser Tedavisinde Yeni Bir Oyuncu: FAK İnhibitörleri
Defactinib, fokal adezyon kinaz (FAK) inhibitörüdür ve FAK proteininin aktivitesini baskılayarak etki gösterir.
FAK, hücreler arası iletişimde, hücrelerin çevresel sinyalleri algılamasında ve hücre göçünde rol oynayan bir tirozin kinazdır. Tümör hücrelerinde FAK sinyalleşmesi, metastaz ve ilaca direnç mekanizmalarının gelişmesinde önemli bir yere sahiptir.
Defactinib:
- FAK aktivitesini engelleyerek tümör hücrelerinin adezyon ve hareket yeteneğini azaltır.
- Tümör mikroçevresinde bağışıklık yanıtını düzenleyerek, bağışıklık sisteminin tümörle savaşma kapasitesini artırabilir.
- Kanser kök hücrelerinin hayatta kalmasını engelleyerek, kanserin yayılımını ve ilaç direncini önleyebilir.
Bugüne kadar FDA tarafından onaylanmış bir FAK inhibitörü bulunmamaktadır.
Bununla birlikte FDA onaylı RAF/MEK inhibitörleri bulunmaktadır. RAF/MEK inhibitörleri, kanser tedavisinde özellikle melanom, akciğer kanseri ve diğer bazı solid tümörlerde kullanılan hedefe yönelik ilaçlardır.
- RAF (BRAF) inhibitörleri, vemurafenib (Zelboraf), dabrafenib (Tafinlar), encorafenib (Braftovi).
- MEK inhibitörleri, trametinib (Mekinist), cobimetinib (Cotellic), binimetinib (Mektovi).
Avutometinib de bir oral RAF/MEK inhibitörüdür, fakat henüz over kanseri veya başka bir kanser için FDA onayı almamıştır.
RAMP 201 Faz 2 Klinik Çalışması
Yeni ilaç başvurusu, RAMP 201 adlı faz 2 klinik çalışmadan elde edilen verilerle destekleniyor. Bu çalışma, avutometinib (oral RAF/MEK inhibitörü) ile defactinib (oral FAK inhibitörü) kombinasyonunun tekrarlayan LGSOC hastalarındaki etkinliğini ve güvenliliğini değerlendirmek amacıyla yapıldı.
Dozlama:
- Avutometinib: Haftada iki kez 3.2 mg
- Defactinib: Günlük iki kez 200 mg
Sonuçlar
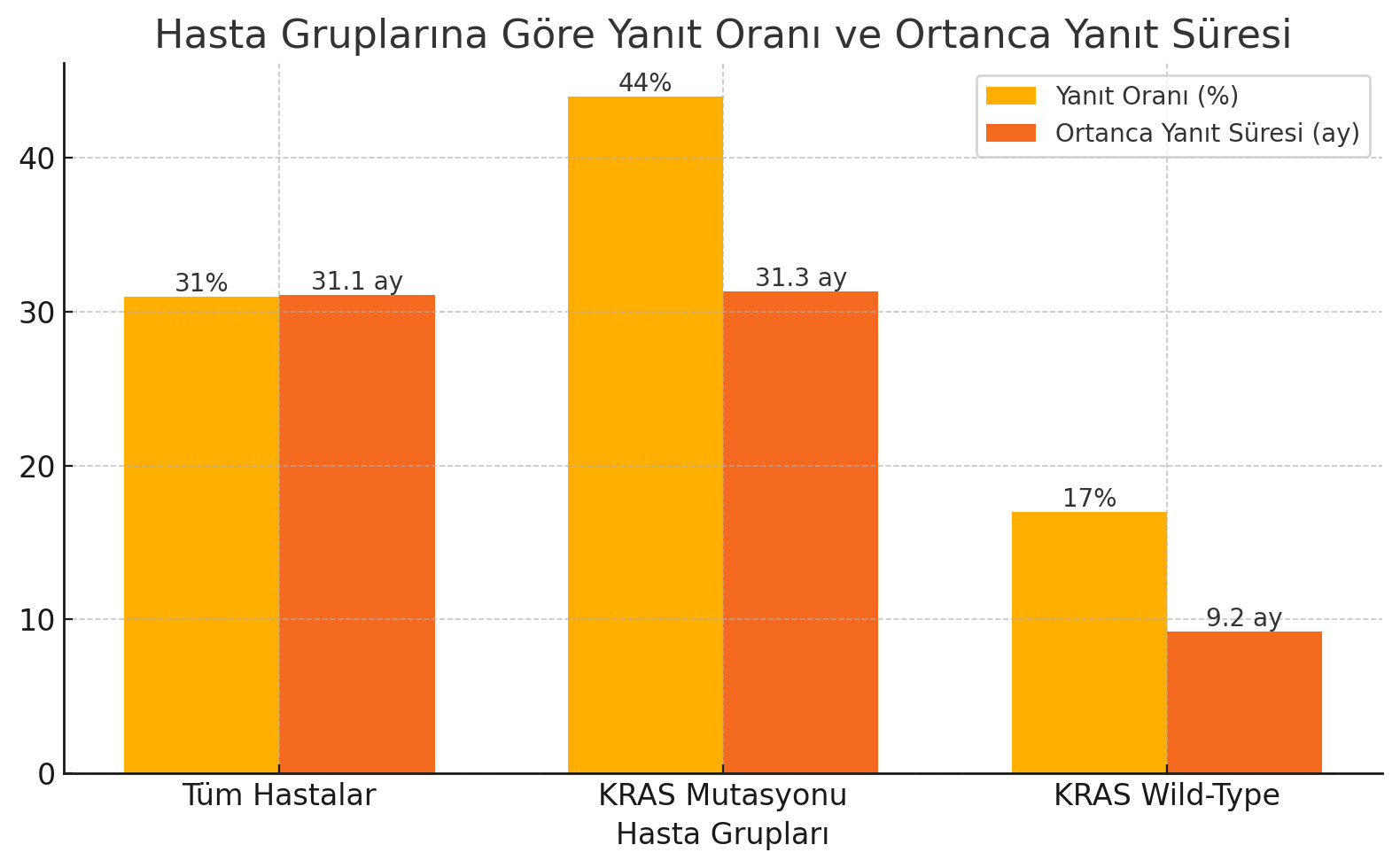
Tüm Hastalar
- Genel Yanıt Oranı (ORR): %31
- Ortanca Yanıt Süresi: 31.1 ay
KRAS Mutasyonu Taşıyan Hastalar
- Yanıt Oranı: %44
- Ortanca Yanıt Süresi: 31.3 ay
KRAS Wild-Type Hastalar
- Yanıt Oranı: %17
- Ortanca Yanıt Süresi: 9.2 ay
Progresyonsuz Sağkalım:
- Tüm hastalar için ortanca progresyonsuz (PFS) sağkalım: 12.9 ay
- KRAS mutasyonu olan hastalar: 22 ay
- KRAS wild-type hastalar: 12.8 ay
Tedavinin Tolerabilitesi
Kombinasyon tedavisi genel olarak iyi tolere edildi. En yaygın tedaviye bağlı yan etkiler şunlar oldu:
- Bulantı
- İshal
- Kreatin kinaz seviyelerinde artış
Yan etkiler nedeniyle tedaviye ara verilmesi ya da doz düşürülmesi durumları nadirdi.
RAMP 301 Faz 3 Denemesi
Verastem Oncology, KRAS mutasyon durumu fark etmeksizin tekrarlayan LGSOC hastalarının dahil edildiği RAMP 301 faz 3 çalışmasına hasta kayıtların devam ettiğini belirtti. Bu çalışma, faz 2 sonuçlarının güvenirliğini teyit etmek amacını taşıyor.
Avutometinib ve Defactinib Temin Edilebilir mi?
Avutometinib ve defactinib kombinasyonu, henüz FDA onayı almamış olup ticari kullanıma sunulmamıştır. Bu tedavi şu anda klinik araştırmalar kapsamında değerlendirilmektedir ve FDA’nın nihai onay kararı beklenmektedir.
Sonuç ve Yorum
Avutometinib ve defactinib kombinasyonu, KRAS mutasyonlu LGSOC hastaları için önemli bir ilerleme potansiyeli sunuyor. FDA’nın öncelikli inceleme kararı, bu tedavinin umut vaadeden etkinlik verilerini yansıtıyor.
Eğer onaylanırsa, LGSOC tedavisinde çok az tedavi seçeneğinin bulunduğu bir alanda yeni bir standart oluşturma ihtimali bulunuyor. FDA’nın karar tarihi olarak 30 Haziran 2025 belirlendi ve bu süreç, hastalar ve klinisyenler için heyecanla bekleniyor.
1. Verastem Oncology announces FDA acceptance and Priority Review of New Drug Application for avutometinib in combination with defactinib for the treatment of recurrent KRAS mutant low-grade serous ovarian cancer. News release. Verastem Oncology. December 30, 2024. https://www.businesswire.com/news/home/20241230294719/en/Verastem-Oncology-Announces-FDA-Acceptance-and-Priority-Review-of-New-Drug-Application-for-Avutometinib-in-Combination-with-Defactinib-for-the-Treatment-of-Recurrent-KRAS-Mutant-Low-Grade-Serous-Ovarian-Cancer.
2. Verastem Oncology presents positive updated RAMP 201 data for avutometinib and defactinib combination in recurrent low-grade serous ovarian cancer at the International Gynecologic Cancer Society (IGCS) 2024 Annual Meeting. News release. Verastem Oncology. October 17, 2024. https://investor.verastem.com/news-releases/news-release-details/verastem-oncology-presents-positive-updated-ramp-201-data.