Türk Ekipten Kanser Tedavisi için Bakteri Temelli Biyohibrit Mikrorobot Keşfi
15 Temmuz’da Science Advances adlı dergide yayımlanan bir çalışma, bilim dünyasına damgasını vurdu. Prof. Dr. Metin Sitti’nin liderliğini yaptığı Almanya Max Planck Enstitüsün’den bilim insanları, E. coli adlı bakteriyi, mikrorobot olarak kullandıkları bir yöntemi duyurdu. Ekip, ilaç moleküllerini taşıyan, 3-boyutlu biyolojik materyalde gezinmek ve istenildiğinde taşıdığı yükleri teslim etmek için manyetik olarak yönlendirilebilen tamamen hareketli biyohibrit mikrorobotlar yaptılar. Bu çalışma, bakteriyel biyohibrit mikrorobotların çeşitli biyolojik matrisler boyunca nasıl yönlendirilebildiğini bilim dünyasına gösterdi.
Max Planck Institute Intelligent Systems (MPI-IS) The Physical Intelligence bölüm başkanı Metin Sitti, çalışmaları için şunları söyledi;
“Tıbbi fonksiyonelliklerle birlikte bakteri-temelli biyohibrit mikrorobotlar, bir gün kansere karşı daha etkili savaşabilecekler. Bu, bugün kanseri nasıl tedavi ettiğimizden çok da uzak olmayan yeni bir tedavi yaklaşımıdır. Tümör hücrelerini aramak ve tahrip etmek için tıbbi mikrorobotlar kullanılabilir. Çalışmamız, toplumumuza fayda sağlamayı amaçlayan temel bilim araştırmalarının harika bir örneğidir.”
E.coli, sıvılardan yüksek yoğunluklu dokulara kadar değişen materyallerde gezebilen çok amaçlı ve hızlı yüzücü denebilecek bir bakteridir. Bu organizmalar ayrıca yüksek derecede gelişmiş algılama yeteneğine sahiptirler. 10 yıldan daha fazla süredir bilim insanları, bakterileri bu tür hastalıklarla mücadeleye yardımcı olmak için ekstra bileşenler ile donatarak bu mikroorganizmanın yeteneklerini daha da artırmanın yollarını aramaktadır.
Makalelerinde ekip şu sonuca vardı; “Genel olarak burada sunulan bakteriyel biyohibrit tasarım, biyolojik engelleri aşabilen ve uyaranlara duyarlı aktif ilaç salınımı gerçekleştirebilen çok işlevli tıbbi mikrorobotlar için sistematik ve yüksek verimli bir platform sağlar.”
Bakteriler, tümör dokusunun yakınında yaygın olan düşük oksijen seviyeleri ya da yüksek asitlik gibi kimyasal zorluklara dayanıklı ve eğilimlidir. Yakınına bakteri enjekte etme ile kanser tedavi etme, bakteri aracılı tümör tedavisi olarak bilinir. Mikroorganizmalar, tümörün olduğu bölgeye akarlar ve bu yolda hastanın bağışıklık sistemini aktive ederler. Aslında bakteri aracılı tümör tedavisi, oldukça uzun bir süredir denenmektedir, fakat bu yeni çalışma, bu araştırmalara yeni bir soluk getirdi.
Yapay bileşenlerle (örneğin, mikro/nano taşıyıcılar) kendiliğinden hareket eden bir organizmayı (örneğin bakteri veya alg) birleştiren biyohibrit mikrorobotlar, algılama ve hedefleme mekanizmalarına sahiptir. Ve mikrorobotların farklı türleri arasında, bakteri ile çalışan biyohibritler, diğerlerinden ön plandadır. Bu nedenle bakteriyel biyohibritler, özellikle kontrast ajanlar, terapötikler ve hedefleme parçaları gibi çoklu fonksiyonel birimlerle tasarlandığında, tıbbi mikrorobot uygulamaları için ideal adaylar haline gelir.
Ancak bakteriye yapay bileşenleri eklemek, kolay bir iş değildir. Karmaşık kimyasal reaksiyonlar söz konusudur. Araştırmacılar, biyohibrit mikrorobotlar tasarlamak için kullanılan tekniklerin çoğunun istenmeyen etkilere sahip olabileceğini ve örneğin bakterilerin nasıl hareket ettiğini veya protein ekspresyonunu değiştirdiğini vurgulamaktadır.
Mevcut çalışmayı gerçekleştiren ekip bu çalışmada, daha önce bildirilen E. coli tabanlı mikrorobotlardan daha iyi performans gösteren, orijinal hareketliliklerini koruyan ve biyolojik materyal aracılığıyla yönlendirilme ve tümör sferoidlerini (küremsi yapılarını) kolonize etme yeteneği sergileyen bakteriyel biyohibritlerin gelişimini bildirdi.
Çalışmalarında araştırmacılar, yaklaşık olarak %90 etkinlikle hem lipozomal (yağ molekülü parçacıkları) hem de manyetik parçacıklar ile bakterinin donatılmasını sağladılar. Bunu yapmak için ekip önce her bir bakteriye nanolipozom (NL) bağladı. Nanolipozomlar, suda çözünür kemoterapi ilacı doksorubisini (DOX) kapsüllemek için tasarlanmış ve yapılandırılmıştır. Yakın kızılötesi ışıkla aydınlatıldığında eriyen tıbbi bir floresan boya olan indosiyanin yeşili (ICG), nanolipozomların çift katmanlı fosfolipid tabakasına gömüldü. Ekip, “…biz, yakın kızılötesi ışığını emebilen ve onu ısıya dönüştürebilen, çift katmanlı fosfolipid tabakasına gömülü ICG’ye sahip, fototermal olarak aktif bir lipozomal formülasyon tasarladık, bu da sonuçta lipid membrandaki yapısal değişiklikleri ve intralipozomal içeriğin, yani kemoterapi moleküllerinin salınımını tetikler.” dedi.
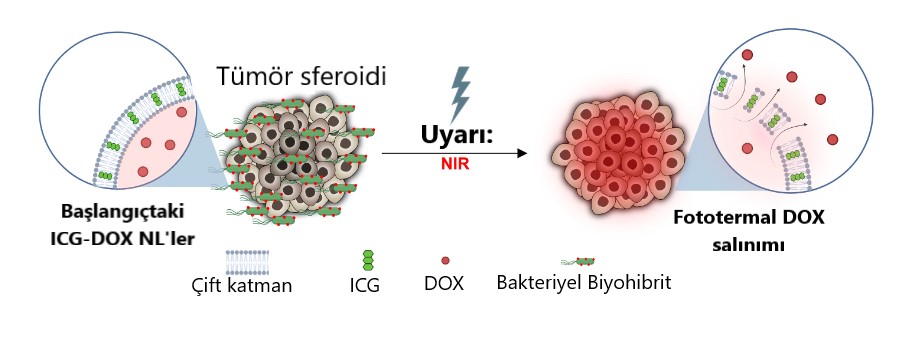
Şekil – 1: Uyaranlara duyarlı ICG-DOX NL'ler taşıyan bakteriyel biyohibritler, tümör sferoidlerine göç eder ve NIR uyarısı üzerine yüklerini serbest bırakır. NL'ler ışık enerjisini ısıya dönüştürür, bu da daha sonra fosfolipid parçalanmasına neden olur ve nihayetinde DOX moleküllerinin salınımını tetikler.
Araştırmacılar ayrıca her bakteriye manyetik nanoparçacıklar da ekledi. Manyetik alana maruz kaldığında, demir oksit partikülleri, zaten oldukça hareketli olan bu mikroorganizma için üst düzey bir güçlendirici görevi görür. Bu yolla, bakterilerin akışını kontrol etmek daha kolaydır – bu, in vivo uygulamaya yönelik geliştirilmiş bir tasarımdır. Lipozomlar ve manyetik parçacıklar, birkaç yıl önce geliştirilmiş olan ve biyohibrit mikrorobotların yapımında faydalı olan, kırılması zor bir streptavidin ve biyotin kompleksi kullanılarak bakteriye bağlandı.
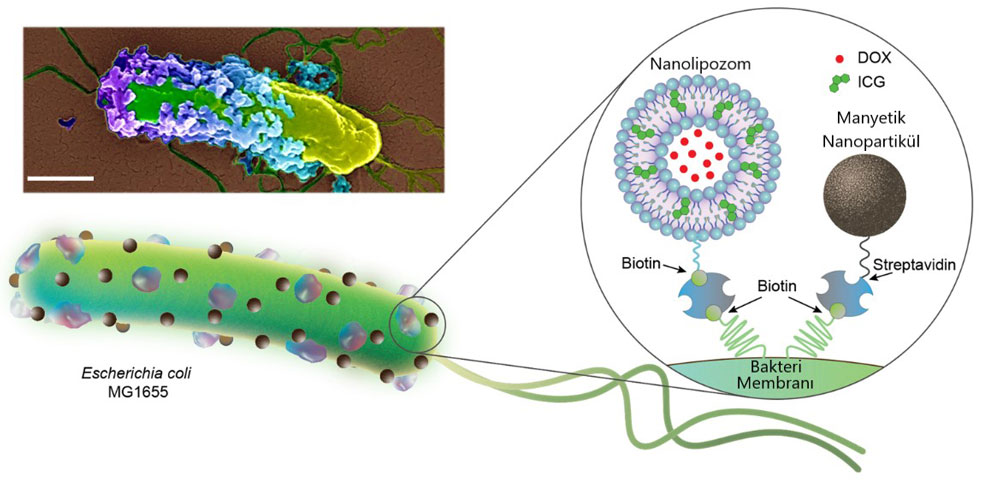
Şekil – 2: Nanolipozomlar (200 nm) ve manyetik nanopartiküller (100 nm) taşıyan bakteriyel biyohibritler. Nanolipozomlar kemoterapötik DOX ve fototermal ajan ICG ile yüklenir ve her iki taşıyıcı da biotin-streptavidin etkileşimleri yoluyla 2 ila 3 µm uzunluğundaki E. coli bakterilerine bağlanır.
Ekip, bakteriyel biyohibrit mikrorobotlarla deneyler yaparak, farklı yollarla bakterilerin dışarıdan yönlendirilebileceklerini gösterdi;
- İlk olarak, her birinde bir tümör sferoidi bulunan, her iki ucunda iki bölme bulunan L şeklinde dar bir kanal aracılığıyla.
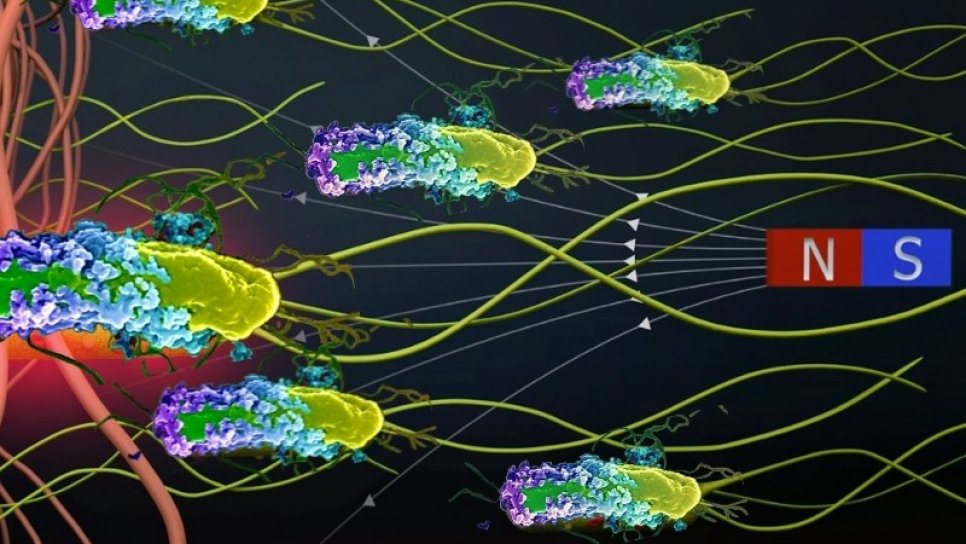
- İkinci olarak küçük kan damarlarına benzeyen çok daha dar bir yapı aracılığıyla. Ekip, bir tarafa bir mıknatıs ekledi ve ilaç yüklü mikrorobotları tümör sferoidlerine doğru nasıl hassas bir şekilde kontrol edebileceklerini gösterdi.
- Üçüncü olarak ise ekip bir adım daha ileri giderek mikrorobotları, yumuşaktan, orta ve sert dereceye kadar değişen üç sertlik ve gözeneklilik düzeyine sahip yoğun bir kolajen jeli (tümör dokusuna benzer) aracılığıyla yönlendirdi. Kollajen ne kadar sert olursa, protein dizileri ağı o kadar sıkı olur ve bakterilerin matris içinden bir yol bulması o kadar zorlaşır.
Araştırmacılar, bir manyetik alan eklediklerinde, bakterilerin daha yüksek bir kuvvete sahip oldukları için jelin diğer ucuna kadar gitmeyi başardıklarını gösterdi. Sabit hizalanma yüzünden, bakteriler lifler arasında bir yol buldu.
"Burada bildirilen sonuçlar, bakteriyel biyohibritlerin, sabit manyetik hizalama altında sınırlı ve gözenekli bir biyolojik mikro-ortama nüfuz edebildiğini ve hareket edebildiğini gösterdi."
Mikrorobotlar, tümör sferoidinde birikmeye yönlendirildikten sonra, 55°C'ye kadar sıcak olabilecek ışın üretmek için yakın kızılötesi bir lazer kullanıldı, bu da lipozomun erime sürecini ve eklenen ilaçların salınmasını tetikledi. Düşük bir pH seviyesi veya asidik ortam da nanolipozomların açılmasına neden oldu – bu nedenle ilaçlar otomatik olarak tümörün yakınında salındı.
"Burada sunulan biyohibrit tasarım ile yalnızca bakterilerin doğal yüzme hızını ve hareketliliğini korumayı başarmadık, aynı zamanda çeşitli manyetik alanlar ve akış koşulları kullanarak bakteriyel biyohibritlere aktif olarak rehberlik ettik ve bölgesel olarak ‘moleküler kargo’ dağıtım uygulamaları için önemli bir özellik olabilecek tümör sferoidlerinin kolonizasyonunu gösterdik.”
MPI-IS The Physical Intellegence bölümünden çalışmanın ilk yazarı Birgül Akolpoglu şunları söyledi;
"Bir kanser hastasının vücuduna bu tür bakteri bazlı mikrorobotları enjekte edeceğimizi hayal edin. Bir mıknatısla parçacıkları tam olarak tümöre doğru yönlendirebiliriz. Yeterli sayıda mikrorobot tümörü çevrelediğinde, dokuya bir lazer yöneltiyoruz ve bu sayede ilaç salınımını tetikliyoruz. Şu anda bağışıklık sistemi, sadece uyanması için tetiklenmiyor, ayrıca ek ilaçlar da tümörü yok etmeye yardımcı oluyor."
Çalışmanın eş-başyazarlarından Yunus Alapan ise şunları söyledi:
"Bu, tümör bölgesine (bakteri bazlı mikrorobotlar ile) ilaç ulaştırma işlemi, hasta için minimal invaziv, ağrısız, minimum toksisiteye sahip olacaktır ve ilaçlar, etkilerini tüm vücudun içinde değil, gerektiğinde (tümör bölgesinde) gösterecektir."
Yazarlar çalışmanın sonucu olarak şunları söyledi;
“Tasarım stratejimiz,
- İşlev kazandırıldıktan sonra bakteriyel biyohibritlerin hareketliliğini sürdürme
- Üç-boyutlu matris tutunma yetenekleri
- Uyaranlara duyarlı moleküler kargo teslimatı
ile birlikte olağanüstü performans ve çok işlevli bakteri temelli biyohibrit mikrorobotlar için gelişmiş ve optimize edilmiş bir üretim rotası oluşturur. Burada bildirilen biyohibrit tasarım, E. coli içeren önceki biyohibrit tasarımlardan çok daha yüksek hareket hızlarına sahip, manyetik olarak kontrol edilen bir biyohibrit mikrorobotik sistem için oldukça verimli bir birleştirme rotası sunar.”
1. Akolpoglu M. B., Alapan Y., Dogan N. O., Baltaci S. F., Yasa O., Aybar Tural G., & Sitti M. Magnetically steerable bacterial microrobots moving in 3D biological matrices for stimuli-responsive cargo delivery. Science Advances, 15 July 2022.
2. Steerable Bacteria-Based Biohybrid Microrobots Developed to Deliver Anticancer Drugs. (2022). GEN: Genetic Engineering & Biotechnology News genengnews.com