Kanser Araştırmaları, Tanı ve Tedavisinde Yapay Zekâ ile Gelinen Son Nokta
Adını çokça duyduğumuz yapay zekâ (YZ), makine öğrenimi ve derin öğrenme teknikleri, potansiyel uygulamaları çok geniş ve önemli olan onkoloji alanındaki biyomedikal araştırmalarda ve sağlık hizmetlerinde de yerini alıyor. Onkolojide yapay zekâ çalışmaları, kanser tanısı, kanserin alt tiplerinin belirlenmesi, kanser tedavilerinin optimizasyonu ve ilaç keşiflerinde yeni aday ilaçların tanımlanması gibi birçok alanı kapsamaktadır. Hali hazırda makine öğrenim modellerinin ihtiyaç duyduğu büyük tıbbi veriler zaten mevcuttur, fakat hem kanser araştırmalarında hem de klinik alanda yapay zekanın tam gücünü gerçekleştirmesi ve bu fırsattan yararlanmak için aşılması gereken önemli engeller bulunmaktadır.
Peki kanser tanısını, hastalarda kanserin gidişatını, tedaviyi iyileştirmek ve yeni ilaç keşiflerini yönlendirmek için yapay zekayı nasıl uygulamaya başlayabiliriz?
Bu konuda alanında uzman dört bilim insanı; Cornell Üniversitesi’nden Fizyoloji ve Biyofizik Profesörü Olivier Elemento, Memorial Sloan Kettering Kanser Merkezi’nden Fizyoloji, Biyofizik ve Sistem Biyolojisi Profesörü Christina Leslie, Finlandiya Helsinki Üniversitesi ve İsveç Karolinska Enstitüsü’nden Tıbbi Teknoloji Profesörü Johan Lundin ve Duke Üniversitesi ve Knoxville Tennese Üniversitesi’nden Radyoloji Profesörü Georgia Tourassi, merak edilen soruları yanıtladı.
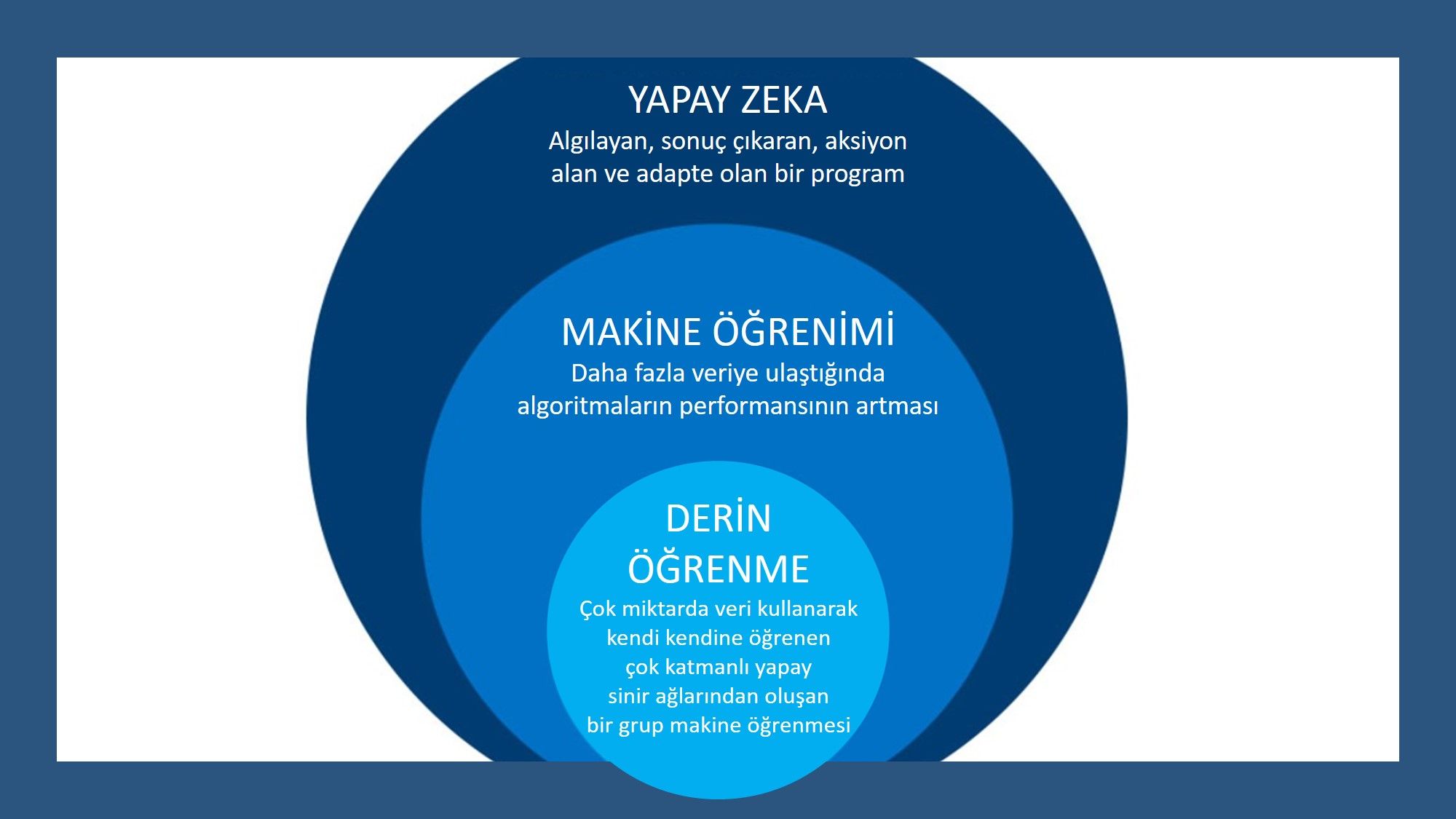
Konunun detaylarına geçmeden önce, yapay zeka, makine öğrenimi ve derin öğrenme kavramlarını aşağıdaki infografi ile özetleyelim:
Kanser Tanı ve Tedavisine Yönelik Umut Vadeden Çalışmalar
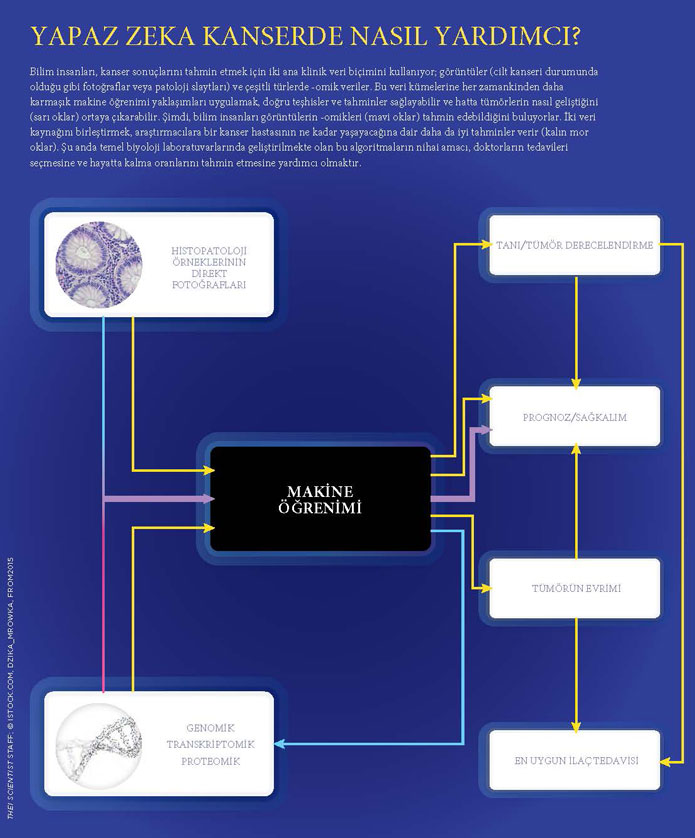
Uzmanlar şüphesiz ki yapay zekâ ve derin öğrenme alanında görüntüleme yöntemlerine odaklanılan çalışmaların umut vadettiğini söylüyor. Son on yılda, kanser araştırmalarında yapay zekâ uygulanmasına yönelik büyük gelişmelere tanık olundu. Bu gelişmeler, derin öğrenme ve artan hesaplama gücünü kapsamaktadır. Patoloji uzmanı doktorların kanser tanısında kullandıkları verilerin dijital ortamlara taşınması ve taşınmaya devam etmesi de bu gelişmeler arasında yer almaktadır. Tıpkı bir sinir ağı algoritması olan AlphaGo22’nin Go oynamayı, oyun sonuçlarına dayanarak öğrenmesi ve tüm Go şampiyonlarını yenerek doğruluğunu kanıtlaması gibi, onkolojide de bir bulutta depolanabilen bu görsel verilerin, eğitilmiş bir sinir ağında yapay zekâ (YZ) algoritmaları ile analiz edilebilmesi mümkündür.
Ayrıca derin öğrenme modeli ile tümörün homojenliği-heterojenliği değerlendirilebilir. Bu alanda hızlı bir şekilde ortaya çıkmış birçok örnek bulunmaktadır. Bu örnekler, kolonoskopi videolarının da analizinde YZ kullanımının mümkün olduğunu düşündürtmektedir.
Tümör tespitinin yanı sıra klinik verilerden yararlanan bilgisayar destekli tedavi seçimi, planlaması ve prognoz (hastalık gidişatı) tahmini, yeni ilaç geliştirilmesi ve toplumda kanser taramaları da umut verici çalışma alanlarıdır.
Artan ilaç sayı ve çeşidi, ayrıca kombinasyon tedavilerinin de işin içine girmesi ile onkolojide tedavi seçimi giderek daha karmaşık hale geldi. Bu sorunlar, yapay zekâ alanındaki gelişmelerle çözümlenebilecek, hangi ilacın hangi ilaç ile kombinasyonunun hasta için daha etkili olabileceği tahmin edilebilecek. Böylelikle hastaların genetik ve epigenetik değişkenliklerine de dayanarak bireyselleşmiş tedaviler onkolojide yerini alacaktır.
Primer aminoasit dizisinden proteinin 3D yapısını tahmin eden derin öğrenme modelleri de ayrıca yeni bir mühendislik atılımıdır. Bunların yapılabilmesi için yapay zekanın kullanılması ve sonuçların deneysel verilerin yerini alabilecek kadar doğru çıkması, yeni bilimsel bilgilerin üretilmesini de destekleyebilir.
Yapay Zekanın Klinik Uygulamalarda Kullanılmasındaki En Büyük Zorluk
Biyomedikal araştırma literatürü ile klinik uygulamalarda kullanılan YZ modelleri arasında büyük bir boşluk vardır. Çoğu YZ modeli, klinikte uygulanamaz durumdadır. Bunun birinci nedeni, hızla değişen onay alma adımlarıdır. Bir diğer neden ise yapay zekanın klinik iş akışına entegre edilmesi ve güncellenen yeni iş akışı ile birlikte personellerin eğitilmesindeki gerekliliktir, ki bu süreç önemli ölçüde zaman ve yatırım gerektirmektedir.
En temel sorun ise genellikle yapay zekâ modellerinin klinik uygulamalarda, veri kalitesi, veri giren ve analiz eden farklılıkları, hasta özelliklerindeki farklılıklar gibi girdilerde meydana gelen çeşitlilik nedeni ile dalgalanmalar yaşamasıdır. Bu dalgalanmalar karşında ya YZ modelleri test edilmemiş ya da test sonuçları açıkça performansta bozulma göstermiştir. Klinikte başarı için mevcut YZ modellerinin gerçekçi performans değerlendirmelerine kesinlikle ihtiyaç bulunmaktadır.
Dijitalleştirme ise yapay zekayı klinik ortama uygulamadaki gerekli ön koşullardan bir diğeridir. Radyolojide dijital dönüşüm çoktan gerçekleşmiştir, ancak patolojide durum aynı değildir. 20 yıldan fazla bir süredir, patoloji verilerinin dijitalleştirilmesine yönelik araçlar mevcuttur ancak ilerleme yavaştır. Bu teknolojiyi basitleştirmek, maliyeti düşürmek ve sınırlı kaynaklara sahip ortamlarda da kullanabilmek için daha fazla yeniliğe ihtiyaç duyulmaktadır.
Ayrıca iletişim de önemli bir konudur. YZ raporlarının doktorlara nasıl ulaşacağı, bu raporların nasıl görüneceği, doktorun bu rapordaki bilgileri hastanın klinik yönetiminde nasıl kullanacağı hala net değildir.
Son olarak, insanların yapay zekâ teknolojisi ile iş birliği içinde çalışması, yapay zekaya aşırı güvenmelerine yol açabilir ve bu da hatalar ile sonuçlanabilir. Kullanıcıların herhangi bir hataya karşı daima uyanık olmaları ve buna dair eğitimler almaları da önemli bir konudur.
Yapay Zekada Şeffaflık, Tekrarlanabilirlik ve Doğrulamanın Önemi
Klinikte ve araştırmalarda YZ modellerine karşı güven için daha fazla şeffaflık, tekrarlanabilirlik ve doğrulama oldukça önemlidir.
Ancak şeffaflık, algoritmaların parametrelerinin okunabildiği ve ne yaptığının anlaşılabildiği ise bu, gelecekte yapay zekâ algoritmalarının çoğu için mümkün olmayacaktır. AlphaZero kendi kendine satranç, shogi ve Go oynamayı o kadar iyi öğrendi ki en iyi ustaları bile yendi. Ama onun oyun oynamayı öğrendiği kuralları anlayabileceğimize, hatta anlamamız gerektiğine inanmak için gerekli bir neden yoktur.
Tekrarlanabilirlik ise aynı veri kümesi üzerinde bir algoritmayı yeniden eğittiğimizde aynı sonucu alacağımız anlamına geliyorsa, eğitilmiş olan algoritma, model kararlılığına sahip olmalıdır. Eğitilen YZ algoritmaları daha sonra test edilmeli ve doğrulanmalıdır. Tüm algoritmalara “eğitim kümesinde” eğitildikten sonra “test etme kümesinde” test edilir. Ancak bu adımlarda genellenebilirlikten bahsedilmez. Bunun için doğrulama veri kümesine ihtiyaç duyulmaktadır.
Özetle, yapay zekada şeffaflık, tekrarlanabilirlik ve doğrulama sağlamak için veri toplamadan yapay zekâ geliştirmeye, klinik dağıtımdan sürekli kalite kontrolüne kadar yapay zeka yaşam döngüsü boyunca çok yönlü bir yaklaşımı dikkate almamız gerekebilir.
Kısa ve Uzun Vadede Onkolojide Yapay Zekanın Geleceği
Yapay zekâ modellerinin büyüme hızı ve uygulama genişliğinin yanı sıra veri ve bilgi işlem kaynaklarının kullanılabilirliğine bağlı olarak bu modellerin önümüzdeki birkaç yıl içinde, kanserdeki önemli sorunlara yönelik uygulamalarının giderek arttığınız göreceğiz. Patolojinin dijitalleşme hızı katlanarak arttıkça ve yapay zekâ modellerini eğitmek için veriler giderek daha fazla erişilebilir hale geldikçe belirli tedavilere yanıtı tahmin eden yapay zekâ modellerinin klinik kullanımına uygulamak için yeterli olgunluğa ve performansa ulaşacaktır. Aynı zamanda YZ modelleri, bireysel olarak hastaların ve hastalığına özgü sonuçların tahminleri sağlamak için prognostik sonuçlar konusunda eğitileceklerdir.
Ayrıca kritik biyolojik belirteçleri (örneğin epigenomik sinyalleri ve 3D kromatin temaslarını) öngören dizi modelleri, kanser genomlarındaki kodlanmayan somatik varyasyonun işlevini sistematik olarak değerlendirmek için kullanılacak ve hastaların RNA prosesini değiştiren mutasyonlarını taramak için benzer tahmine dayalı ekleme ve alternatif poliadenilasyon modelleri de kullanılacaktır.
Sonuç
Uzun vadede ise yapay zekâ algoritmalarının amacı, tanıyı iyileştirmek, optimal bireysel hasta tedavilerinin seçimine yardımcı olmak, hasta sonuçlarını iyileştirmek ve sağlık masraflarını azaltmak olacaktır. Kanserin altında yatan biyolojik mekanizmaların daha iyi anlaşılmasında, kombinasyon tedavilerin ve dozajların belirlenmesinde ve ayrıca daha az toksisiteye sahip yeni antikanser ilaçların geliştirilmesinde kullanılabilecektir. Hatta şu anda kullanılan mamografi gibi görüntüleme yöntemlerinin geliştirilerek kanser geliştirme riskini tahmin eden ve kanserin önlenmesine yardımcı olabilen modellere yönelik çalışmalara odaklanılacaktır.
Elemento, O., Leslie, C., Lundin, J. et al. Artificial intelligence in cancer research, diagnosis and therapy. Nat Rev Cancer 21, 747–752 (2021).