Tümör Organoidleriyle Kişiselleştirilmiş Tedavi Seçiminde Büyük Adım
Son yıllarda tümör organoidleri (tümöroidler), kişiselleştirilmiş kanser tedavisinde dikkat çeken ve umut vadeden bir yöntem haline gelmiştir. Bu teknolojiler, hastanın tümörünün genotip ve fenotip özelliklerine göre tedavi seçimini destekleyerek, klinik karar sürecinde aktif rol oynamaktadır. Preklinik araştırmaları doğrudan klinik uygulamalara entegre eden bu yaklaşım, onkolojide çığır açan gelişmelere sahne olmaktadır.
Tümör Organoidi Nedir?
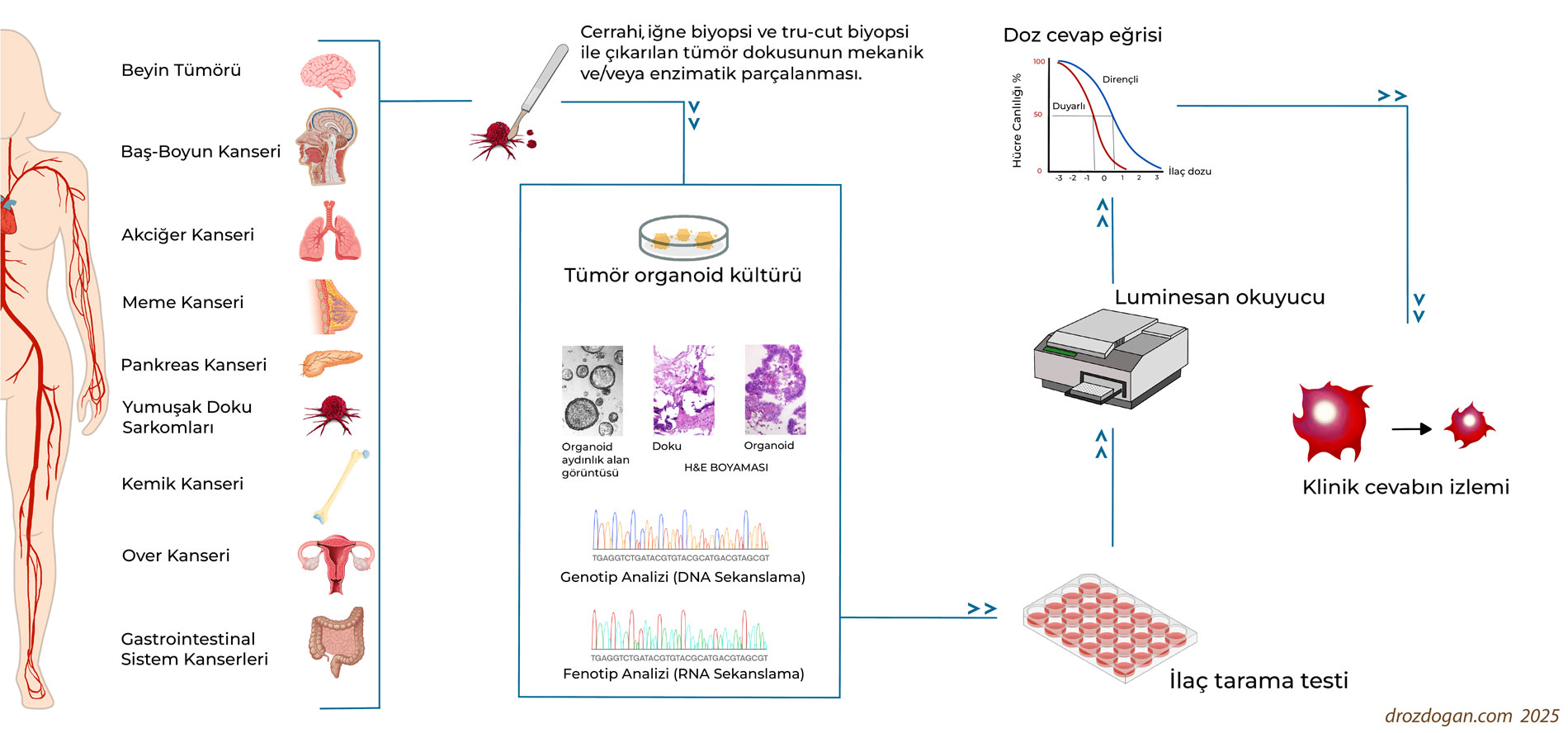
Tümör organoidleri, hastalardan alınan primer veya metastatik tümör dokusunun özel kültür koşullarında, belirli biyomoleküller ve matris ortamlarıyla 3 boyutlu olarak yeniden yapılandırılmasıyla elde edilen mini tümör modelleridir (Şekil 1).
Adeta "in vitro tümör avatarları" olarak adlandırılabilecek bu yapılar, hem tümör hücrelerini hem de mikroçevresini taklit ederek gerçekçi bir model sunar. Bu organoidler, doku örneklerinin yanı sıra vücut sıvılarında dolaşan tümör hücrelerinden de üretilebilir, ancak bu durumda başarı oranı ve oluşma süresi daha düşüktür.
Organoid Oluşturma ve Doğrulama Süreci
Başarılı bir organoid oluşturulabilmesi için biyopsi ile elde edilen dokunun yeterli miktarda olması ve genetik (DNA), transkriptomik (RNA), proteomik (protein) ve morfolojik özelliklerinin orijinal tümörle yüksek düzeyde benzerlik göstermesi gerekir. Bu sürecin tamamlanması, örnek tipine göre 2 ile 8 hafta arasında değişebilir.
İlaç Duyarlılık Testleri (DST)
Organoidler oluşturulduktan sonra, hastanın klinik ve moleküler geçmişi göz önünde bulundurularak bir ilaç paneli belirlenir. Bu panelde kemoterapi ajanları, hedefe yönelik tedaviler ve immünoterapiler yer alabilir. Seçilen ilaçlar, farklı dozlarda ve tekrarlı şekilde organoidler üzerinde test edilerek, tümöre karşı duyarlılıkları belirlenir ve tedavi planına yön verecek detaylı bir rapor hazırlanır.
Klinik Başarılar ve Uygulamalar
2020 yılından sonra organoidlerin teknolojisi konusundaki araştırmalar hızla artarken, 2023 yılı organoid çalışmaları alanında binlerce makalenin yayınlanması ile bir dönüm noktası oldu. Son yıllarda klinikte özellikle tümör organoidlerinin hasta tedavi karar destek sistemine dahil olması, klinik pratikte tümöroidlerin başarı hikayelerini yazmaya başladı. 2024 yılı ESMO (Avrupa Tıbbi Onkoloji Derneği) kongresinde Fransa’da 155 hasta tümöroidi ile pankreas ve kolorektal kanser hastalarında yapılan çalışma sunulmuş ve hangi tedavilerin en iyi sonuçları verebileceğini tahmin etmeye yönelik bir araç olarak işlev görmesi yoğun ilgi görmüştür. Bunun yanı sıra diğer yankı uyandıran bir çalışma da 126 hasta ve 24 farklı sarkom alt tipi ile UCLA’dan Dr. Alice Soragni ve ekibinden gelmiştir. Çalışmada 1 hafta içinde sarkom organoidleri oluşturulduktan sonra çok sayıda ilaç denenmiş ve yaklaşık %80’inde en az bir önemli ilaç yanıtı gözlemlenmiştir. Özellikle ALK füzyonları, ROS1, HER2, MET exon 14 skipping ve BRAF gibi nadir mutasyonlara sahip hastalarda, organoid temelli testlerin klinik yanıtları doğru şekilde öngörebildiği gösterilmiştir. Bu başarılar, organoidlerin yalnızca laboratuvar ortamında değil, aynı zamanda gerçek klinik karar süreçlerinde güvenilir bir yol gösterici olduğunu ortaya koymaktadır.
Tümör organoidleri kullanılarak yapılan ilaç duyarlılık testlerinin klinik başarılarını gösteren önemli çalışmalar Tablo 1’de detaylı olarak özetlenmektedir.
TABLO 1: Organoid Temelli İlaç Duyarlılık Testlerinin Klinikle Uyumu: Yayınlanmış Çalışmalar Tablosu
|
Çalışma ekibi |
Çalışma hangi yıllar arasında yapıldı ve yayınlandı |
Hasta-Örnek Sayısı |
Kanser tipi |
Organoid Oluşturma Başarısı |
Denenen tedavi protokolü |
Klinikle Uyumu |
Klinik Detay |
|---|---|---|---|---|---|---|---|
|
Millen ve ark.
|
2019-2022 arasında yapıldı. 2023’de yayınlandı. |
97 hastadan-110 tümoroid model oluşturuldu. |
Baş boyun kanserleri |
Tam bir yüzde verilmemekle birlikte epitel yoğunluğuna göre %35-88 arasında. |
Radyoterapi, kemoradyoterapi, hedefe yönelik ilaçlar |
Radyoterapi için gözlemlenen 27 hastanın (primer=6, postoperatif=21) klinikte cevabı ile organoid sonucu birebir uyumlu çıktı. |
GR50 değeri ile belirlenen duyarlılıkla hastaların nüks durumu arasında anlamlı ilişki (p=0.01); cetuximab çoğu modelde radyoprotektif etki gösterdi; PRMT5 inhibitörü CDKN2A kaybı olanlarda etkili bulundu |
|
Vlachogiannis ve ark. |
2014-2017 arasında yapıldı. 2018’de yayınlandı. |
71 hastadan 110 biyopsi materyalinde yapıldı. |
Metastatik gastrointestinal kanserler |
%70 |
Faz I-III klinik çalışmada olan ve klinik pratikte kullanılan 55 ilaç |
Hastaların %15inde klinikle uyum takip edilebildi. Uygulanan ilaçlar ve hastaların genetik profiline göre organoid-hasta uyumluluğu yaklaşık %80 uyumlu çıktı. |
Organoid DST (İlaç Duyarlılık Testi), klinik yanıtı şu doğruluk oranlarıyla öngörmektedir: %100 duyarlılık (sensitivity), %93 özgüllük (specificity), %88 pozitif prediktif değer ve %100 negatif prediktif değer." |
|
Yao ve ark. |
2017-2019 arasında yapıldı. 2020’de yayınlandı. |
112 biyopsi materyali toplandı. 80 hastada etkinlik takip edilebildi. |
Lokal ileri rektal kanser |
%71 |
Radyoterapi, irinotekan ve 5-florourasil |
Tekli ve kombinasyon uygulamaları sonrası klinik cevapla uyum %88 oranlarında çıktı. |
|
|
Chen ve ark. |
2021’de yayınlandı. |
125 hastadan 132 biyopsi materyali toplandı. |
İleri evre meme kanseri |
- |
49 ilaç-bunlardan 30’u meme kanseri için onaylı olmayan ilaçlar |
Organoidlerde IC50 değerlerine göre tam cevaplı, kısmen cevaplı, stabil, PFS, DFS tanımlamalarına göre %61 oranında uyumlu etki gözlenmiştir. |
Everolimus, gemsitabin, sisplatin, vinorelbin, epirubisin, dosetaksel organoidlerde etkili bulunmuş ve hastalarda kısmi cevap, PFS ve DFS ile korele edilmiştir. |
|
Hogenson ve ark. |
2017–2021 arasında yapıldı. 2022’de yayınlandı. |
163 hasta, 28 PDO analizde kullanıldı |
Gastrointestinal kanserler |
% 51.5 |
5-FU, gemcitabine, oxaliplatin, docetaxel, SN-38, JQ1, SAHA, BGJ398, regorafenib |
%82 (9/11 vaka uyumlu) |
Kolanjiokarsinomda erlotinib ve gemsitabin ile uyumlu iken, TAS-102 ile uyumsuz. Pankreatik duktal adenokarsinomda FOLFOX uyumlu. Kolorektal karsinomda vemurafenib uyumlu, eFT508 uyumlu, bozitinib ve regorafenib uyumlu |
|
Wang ve ark. |
2019-2021 arasında yapıldı. 2023’de yayınlandı. |
107 hastadan 158 akciğer organoidi yapıldı. 54'ünde klinik takip edildi. |
Akciğer kanserleri |
% 75.7 |
14 kemoterapi, 45 tirozin kinaz inhibitörü |
Klinik takipte uyum osimertinib, kemoterapi, ikili hedefli terapi ve diğer hedefli terapi şeklinde sınıflandırıldığında klinik cevapla uyum sırasıyla 86.7% (13/15), 83.3% (10/12), 100% (10/10), ve 70.6% (12/17) olarak bulundu. |
Osimertinib, bir hastada kısmi yanıt alınırken başka bir hastada progresyon (hastalığın ilerlemesi) görülmesiyle, organoid-klinik uyumluluğu açısından dikkat çekici oldu. ALK füzyonlarını hedefleyen organoid verileri ile klinik yanıt arasında %100 uyum sağlandı. ROS1 (P-25), HER2 (P-75), MET exon 14 skipping (P-86 ve P-105) ve BRAF (P-95) gibi mutasyonlara sahip hastalar da organoidlerde ilaç duyarlılık analizine dahil edildi ve bu analiz klinik yanıtı doğru şekilde öngördü. |
Sonuçlar, organoid tabanlı testlerin klinikle uyumlu biçimde etkili ilaçları belirlemede ve etkisiz tedavi seçeneklerini elemede güçlü bir öngörü aracı olduğunu ortaya koymaktadır.
1. Chen, P., Zhang, X., Ding, R., Yang, L., Lyu, X., Zeng, J., Lei, J. H., Wang, L., Bi, J., Shao, N., Shu, D., Wu, B., Wu, J., Yang, Z., Wang, H., Wang, B., Xiong, K., Lu, Y., Fu, S., ... Deng, C. (2021). Patient-derived organoids can guide personalized therapies for patients with advanced breast cancer. Advanced Science, 8, 2101176. https://doi.org/10.1002/advs.202101176
2. Hogenson, T. L., Xie, H., Phillips, W. J., Toruner, M. D., Li, J. J., Horn, I. P., Kennedy, D. J., Almada, L. L., Marks, D. L., Carr, R. M., Toruner, M., Sigafoos, A. N., Koenig-Kappes, A. N., Olson, R. L., Tolosa, E. J., Zhang, C., Li, H., Doles, J. D., Bleeker, J., ... Fernandez-Zapico, M. E. (2022). Culture media composition influences patient-derived organoid ability to predict therapeutic responses in gastrointestinal cancers. JCI Insight, 7(22), e158060. https://doi.org/10.1172/jci.insight.158060
3. Millen, R., de Kort, W. W. B., Koomen, M., van Son, G. J. F., Gobits, R., Penning de Vries, B., Begthel, H., Zandvliet, M., Doornaert, P., Raaijmakers, C. P. J., Geurts, M. H., Elias, S. G., van Es, R. J. J., de Bree, R., Devriese, L. A., Willems, S. M., Kranenburg, O., Driehuis, E., & Clevers, H. (2023). Patient-derived head and neck cancer organoids allow treatment stratification and serve as a tool for biomarker validation and identification. Med, 4(5), 290–310. https://doi.org/10.1016/j.medj.2023.03.001
4. Vlachogiannis, G., Hedayat, S., Vatsiou, A., Jamin, Y., Fernández-Mateos, J., Khan, K., Lampis, A., Eason, K., Huntingford, I., Burke, R., Rata, M., Koh, M., Tunariu, N., Collins, D., Hulkki-Wilson, S., Ragulan, C., Spiteri, I., Moorcraft, S. Y., Chau, I., ... Valeri, N. (2018). Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. https://doi.org/10.1126/science.aao2774
5. Yao, Y., Xu, X., Yang, L., Zhu, J., Wan, J., Shen, L., Xia, F., Fu, G., Deng, Y., Pan, M., Guo, Q., Gao, X., Li, Y., Rao, X., Zhou, Y., Liang, L., Wang, Y., Zhang, J., Zhang, H., ... Hua, G. (2020). Patient-derived organoids predict chemoradiation responses of locally advanced rectal cancer. Cell Stem Cell, 26(1), 17–26.e6. https://doi.org/10.1016/j.stem.2019.10.010
6. Wang, H.-M., Zhang, C.-Y., Peng, K.-C., Chen, Z.-X., Su, J.-W., Li, Y.-F., Li, W.-F., Li, Q.-Y., Gao, Q.-Y., Zhang, S.-L., Chen, Y.-Q., Zhou, Q., Xu, C., Xu, C.-R., Wang, Z., Su, J., Yan, H.-H., Zhang, X.-C., Chen, H.-J., ... Yang, J.-J. (2023). Using patient-derived organoids to predict locally advanced or metastatic lung cancer tumor response: A real-world study. Cell Reports Medicine, 4(2), 100911. https://doi.org/10.1016/j.xcrm.2022.100911