
Erken Evre Meme Kanseri Tedavisi için Abemasiklib FDA Onayı Aldı
Hormon reseptörü (HR) pozitif, insan epidermal büyüme faktörü reseptörü (HER2) negatif, nod-pozitif, yüksek tekrarlama riski taşıyan erken evre meme kanseri olan hastaların adjuvan (ameliyat sonrası koruyucu) tedavisi için endokrin tedavisi (tamoksifen veya aromataz inhibitörü) ile abemasiklib (Yulareb, Verzenios Eli Lilly Company) adlı CDK 4/6 sınıfından ilacı 12 Ekim 2021'de FDA (ABD Gıda ve İlaç İdaresi) onayladı.
Güncelleme: 3 Mart 2023 tarihinde FDA, abemasiklibin bu hasta grubunda kullanılabilmesi için Ki-67 skorunun ≥%20 olması şartını kaldırdı.
Yüksek tekrarlama riski olan hastalar şöyle tanımlanmaktadır:
- patolojik aksiller lenf nodu sayısı ≥4 ya da
- patolojik aksiller lenf nodu sayısı 1-3 ve tümör derecesi 3 ya da
- tümör boyutu ≥50 mm’ye sahip hastalar.
Ki-67 nedir?
Ki-67, hücrede, bölünmeye hazırlanırken artan bir proteindir. Özel bir hücre boyama işlemi ile, Ki-67 için pozitif olan tümör hücrelerinin yüzdesini ölçebilir. Ne kadar pozitif hücre varsa, bu kanserin ne kadar hızlı bölündüğünü ve yeni hücreler oluşturduğunu gösterir. Meme kanserinde %10'dan az sonuç düşük, %10-20 sınırda, %20'den fazla ise yüksek olarak kabul edilir.
monarchE Çalışması ile Gelen FDA Onayı
Etkinlik, HR-pozitif, HER2-negatif, nod-pozitif, ameliyat olmuş, yüksek hastalık nüksü riski ile uyumlu klinik ve patolojik özelliklere sahip erken meme kanseri olan yetişkin kadın ve erkekleri içeren randomize (1:1), açık etiketli, iki gruplu çok merkezli bir çalışma olan monarchE'de değerlendirildi.
Hastalar ya 2 yıllık abemasiklib artı doktorlarının tercih ettiği standart endokrin tedavisini ya da tek başına standart endokrin tedavisini alacak şekilde iki çalışma kolundan birine rasgele atandı.
Başlıca etkinlik sonuç ölçüsü, kanserin tekrarlamasının bir göstergesi olan invaziv hastalıksız sağkalım (invasive disease-free survival= IDFS) idi.
Sonuçlar
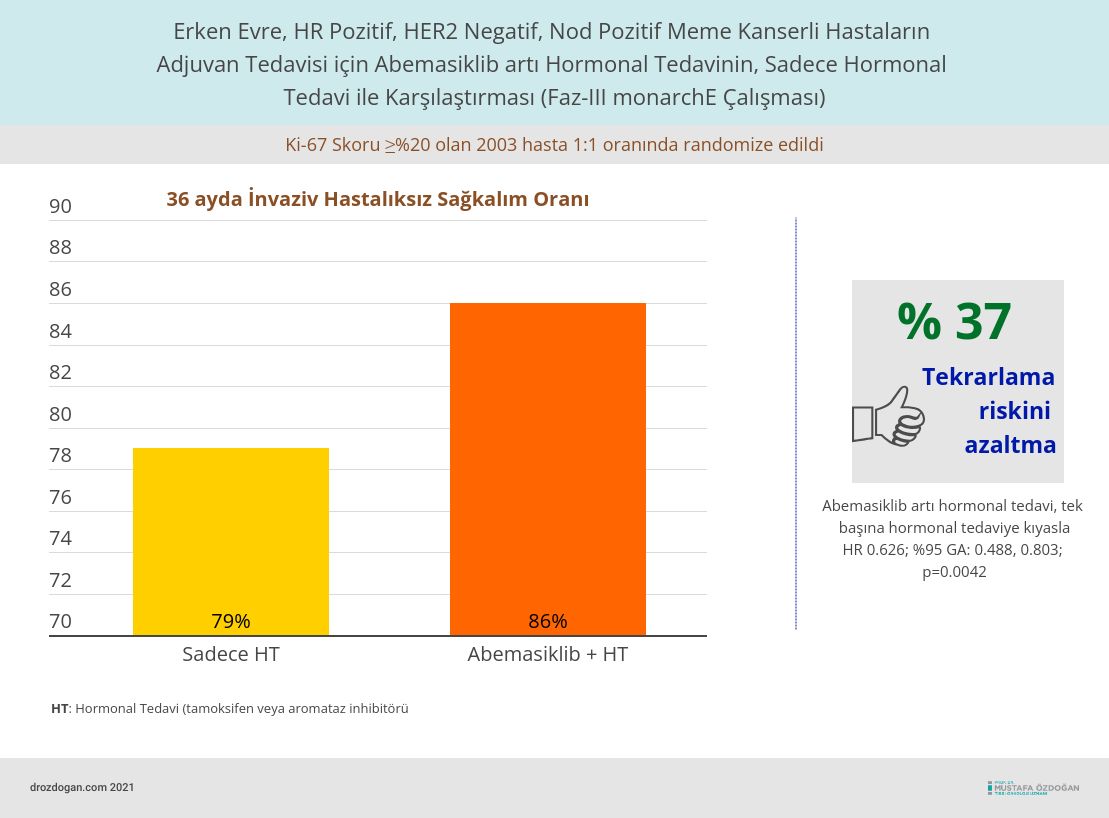
Çalışmaya Ki-67 Skoru ≥%20 ve tekrarlama riski yüksek ve 2003 hasta alındı.
- Abemasiklib kullanımı, hastalıksız sağkalımda anlamlı bir iyileşme gösterdi (HR 0.626; %95 GA: 0.488, 0.803; p=0.0042). Abemasiklib, kanserin tekrarlama ihtimalini %37 azalttı.
- 36 ayda hastalıksız sağkalım, abemasiklib artı tamoksifen veya bir aromataz inhibitörü alan hastalar için %86.1 (%95 GA: 82.8, 88.8) ve sadece hormonal tedavi (tamoksifen veya bir aromataz inhibitörü) alan hastalar için %79 (%95 GA: 75.3, 82.3) olmuştur.
Genel hayatta kalma verileri, hastalıksız sağkalım analizi sırasında olgun değildi.
En sık (≥20%) rastlanan yan etkiler ishal, enfeksiyonlar, nötropeni, yorgunluk, lökopeni, bulantı, anemi ve baş ağrısı idi.
Önerilen abemasiklib başlangıç dozu, 2 yıllık tedavi tamamlanana veya hastalık tekrarlayana veya kabul edilemez toksisiteye kadar tamoksifen veya bir aromataz inhibitörü ile kombinasyon halinde günde iki kez alınan 150 mg'dır.
FDA approves abemaciclib with endocrine therapy for early breast cancer. 13 Oct 2021 fda.gov






