Hekimlerin Çoğu FDA Onay Sürecini Tam Anlamıyor – Peki Ya Hastalar?
Yapılan bir araştırmada, ABD'li hekimlerin sadece %41'inin FDA (ABD Gıda ve İlaç İdaresi) ilaç onay süreçleri hakkında orta veya iyi düzeyde anlayışa sahip olduğunu bildirdi. Bu oran cihaz onay süreçleri için ise %17'de kalıyor.
FDA, yeni tedavilerin geliştirilmesi, test edilmesi ve onaylanması konusunda dünya çapında lider bir kurum olarak öne çıkmaktadır. Ancak, aldığı kararlar yalnızca ABD içerisinde bağlayıcılık taşırken, diğer ülkeler için önemli bir referans noktası ve rehber olarak işlev görür.
FDA, yeni tedavi yöntemleri, ilaçlar ve tıbbi cihazların güvenliğini ve etkinliğini değerlendirmek üzere kapsamlı bir onay sürecini yürüten dünyanın en etkili sağlık otoritelerinden biridir. Bu süreç, kamu sağlığını korumak ve hastalara etkili tedavi seçenekleri sunmak amacıyla tasarlanmıştır. FDA onayı, bir ürünün piyasaya sürülmeden önce katı klinik testlerden ve değerlendirmelerden geçmesi gerektiğini belirtir, bu da hem sağlık profesyonelleri hem de hastalar için bir güvenlik garantisi sunar.
FDA onay süreci, genellikle üç ana kategoride gerçekleşir:
- İlaçlar için Yeni İlaç Başvurusu (NDA= New Drug Application),
- Biyolojik ürünler için Biyolojik Lisans Başvurusu (BLA= Biologics License Application) ve
- Tıbbi cihazlar için Premarket Onayı (PMA= Premarket Approval) veya 510(k) bildirimi.
Yeni bir kanser ilacı için kullanılacak FDA onay süreci, "Yeni İlaç Başvurusu (New Drug Application - NDA)" olacaktır. NDA süreci, ilacın güvenliği ve etkinliği hakkında kapsamlı bilgileri içerir ve genellikle klinik öncesi (hayvanlar üzerinde yapılan deneyler) ve klinik (insanlar üzerinde yapılan deneyler) testlerin sonuçlarını kapsayan detaylı bir dosya sunulmasını gerektirir.
Her bir süreç, ürünün türüne ve kullanım amacına bağlı olarak farklı gereksinimler içerir. Örneğin, ilaçlar genellikle geniş kapsamlı klinik çalışmalar gerektirirken, tıbbi cihazların onaylanması için gereken süreç, cihazın risk seviyesine göre değişiklik gösterir.
FDA'nın onay süreçlerinin çeşitliliği, sağlık profesyonellerinin ve hastaların doğru tedavi yöntemlerine erişimini sağlamanın yanı sıra, yeni tedavilerin güvenli ve etkili bir şekilde geliştirilmesini teşvik eder. Bu sürecin karmaşıklığı, aynı zamanda, hekimler ve hastalar arasında tam olarak anlaşılmamasına yol açabilir. Onay süreçlerinin doğru anlaşılması, sağlık hizmetlerinde bilinçli kararlar alınmasını sağlar ve tedavi sonuçlarının iyileştirilmesine katkıda bulunur.
Bir Kanser İlacı için Onay Alma Süreci Nasıldır?
Kanser ilacı geliştirme süreci, oldukça zaman alıcı ve maliyetli bir yolculuktur. Bu yolculuğun her adımı, ilacın potansiyel faydalarını ve risklerini dikkatlice değerlendirerek, hastalar için güvenli ve etkili tedaviler sağlamayı amaçlar. Aşağıda, kanser ilacı geliştirme sürecine dair bazı kısa ve anektodal bilgiler yer almaktadır:
- Süreç Ne Kadar Sürüyor? Kanser ilacının keşfinden FDA onayına kadar olan süreç genellikle 7 ila 15 yıl arasında değişmektedir. Bu süre, ilacın keşfi, preklinik çalışmalar, klinik deneyler ve son olarak onay aşamalarını içerir.
- Maliyet: Kanser ilacı geliştirme maliyeti, milyar dolarları bulabilir. Amerikan İlaç Üreticileri ve Araştırmacıları Birliği'ne (PhRMA) göre, bir ilacın keşfi ve piyasaya sürülmesinin ortalama maliyeti 2.6 milyar dolar civarındadır. Bu maliyet, başarısız deneyler ve yüksek araştırma geliştirme masraflarını da içerir.
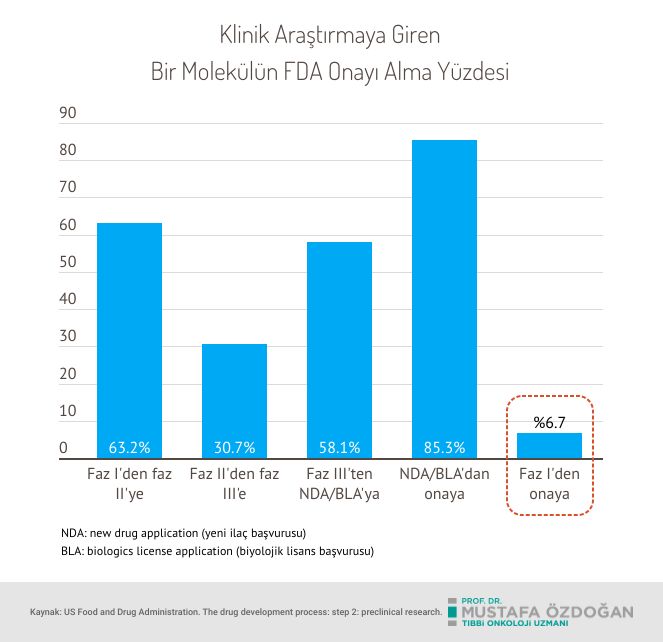
- Onay Sürecinde Başarı Oranları: Kanser ilaçlarının FDA tarafından onay alma oranı düşüktür. Klinik denemeye başlayan ilaçların yaklaşık %5-7'si FDA onayı alır. Bu düşük oran, kanser araştırmasının zorluklarını ve yeni tedavilerin güvenliğini ve etkinliğini kanıtlama gerekliliğini yansıtmaktadır.
- Hızlandırılmış Onay Yolları: FDA, özellikle ciddi veya yaşamı tehdit eden hastalıklar için tedavileri hızlandırmak amacıyla çeşitli hızlandırılmış onay programları sunmaktadır. Bu programlar, Breakthrough Therapy Designation ve Accelerated Approval gibi yöntemlerle, belirli kriterleri karşılayan ilaçların daha hızlı değerlendirilmesine olanak tanır. Ancak, bu ilaçların piyasaya sürülmesinden sonra da etkinliklerini ve güvenliklerini izlemek için takip çalışmaları gereklidir.
- Klinik Deneyler ve Etkinlik Ölçütleri: Kanser ilacı geliştirme sürecinde, ilacın etkinliğini değerlendirmek için genellikle genel sağkalım oranları veya hastalıksız sağkalım gibi sonuç ölçütleri kullanılır. Ancak, bazı durumlarda surrogate ölçütler (örneğin, tümörün küçülmesi) kullanılarak ilacın potansiyel faydası daha erken bir aşamada değerlendirilebilir.
Bu anektodal bilgiler, kanser ilacı geliştirme sürecinin hem zorluklarını hem de bu sürecin neden titiz bir şekilde yürütülmesi gerektiğinin altını çizer. Her yeni kanser ilacı, onay sürecinden geçerken, bu ilaçların geliştirilmesi ve değerlendirilmesi sırasında karşılaşılan zorluklar, sağlık profesyonelleri, araştırmacılar ve hastalar için önemli öğrenme fırsatları sunar.
Hekimler FDA Sürecini Ne Kadar İyi Biliyor?
Health Affairs dergisinde 8 Ocak 2024'te yayımlanan bir araştırmaya göre, birçok hekimin FDA onay süreçleri hakkında sağlam bir anlayışa sahip olmadığı ortaya çıktı. Araştırmacılar, FDA'nın ilaç ve tıbbi cihaz onay süreçleri hakkındaki anlayışlarını değerlendirmek için ABD'li onkologları, dahiliye uzmanlarını ve kardiyologları incelediler.
Ankete eksiksiz yanıt veren 478 hekimin %41'i ilaç onay sürecini orta veya iyi anladığını, %17'si ise tıbbi cihaz onay sürecini orta veya iyi anladığını belirtti. Onkologlar ilaç onayı, kardiyologlar ise cihaz onayı konusunda daha iyi anlayışa sahipti.
Onay Sürecini Az Anlayan Hekimler Ne Düşünüyor?
Onay süreçleri hakkında sınırlı anlayışa sahip olmalarına rağmen, anket yanıt verenlerin çoğu, FDA'nın şu anki onay kriterlerinin hem ilaçlar (59%) hem de cihazlar (66%) için "olması gerektiği gibi" olduğunu söyledi.
Anket katılımcılarının çoğunluğu, FDA'nın çoğu yeni ilaç ve cihaz için 2 veya daha fazla randomize kontrollü klinik araştırmayı zorunlu kılması gerektiğini belirtti (57% ilaç, 60% cihaz). Ancak onkologların %68'i, yani çoğu yeni ilaç için tek bir randomize kontrollü çalışmanın yeterli olduğunu düşündüğünü ifade etti.
Hemen hemen tüm katılımcılar (%98), ilaçlar veya cihazlar surrogate ölçümlere dayanarak onaylanırsa, FDA'nın takip çalışmaları gerektirmesi gerektiğini söyledi. Ancak katılımcıların yalnızca %63'ü surrogate ölçümün ne olduğunu bildiğini belirtti.
Surrogate ölçüm: Bir tedavinin etkisini doğrudan ölçmek yerine, daha kolay ölçülebilen bir göstergeyi kullanmak. Örneğin, bir kanser tedavisinin etkinliğini ölçmek için genel sağkalım süresini ölçmek yerine, tedaviye objektif yanıt oranını (surrogate ölçüm) kullanmak. Kanser tedavilerinin etkinliğini değerlendirmek için genel sağkalım en güvenilir son uç (endpoint) olarak kabul edilir. Ancak, genel sağkalım verilerinin elde edilmesi uzun zaman alabilir ve bu süreçte yeni tedavilerin değerlendirilmesi gecikebilir. Bu nedenle, kısa vadede sonuçları gözlemlemek ve tedavinin potansiyel etkinliğini daha erken bir aşamada değerlendirebilmek için surrogate ölçümler kullanılır.
Araştırmacılar şu sonuca vardılar: "Bu ulusal ankette, birçok hekimin FDA onayı için gerekli kanıt düzeyini anlamadığını ve özellikle hızlandırılmış yollarla piyasaya sürülen ilaçlar ve tıbbi cihazlar için daha katı olmasını beklediklerini veya inandıklarını gördük."
Bu Bulgular Ne Anlama Geliyor?
Bu araştırma, hekimlerin FDA onay süreçleri hakkındaki anlayışının eksik olduğunu ortaya koyuyor. Bu durum, hekimlerin hastalara yönelik tedavi kararlarını verirken ilaç ve cihazların güvenliği ve etkinliği hakkındaki bilgilerini etkileyebilir.
Daha fazla araştırma, hekimlerin FDA onay süreçleri hakkındaki anlayışını artırmanın en iyi yollarının neler olduğunu belirlemelidir. Bu, hastaların daha güvenli ve etkili tedaviler almalarına yardımcı olabilir.
Türkiye'deki Kanser Hastaları Bu Yazıdan Şunları Anlamalıdır
- FDA, yeni tedavilerin geliştirilmesi, test edilmesi ve onaylanması konusunda dünya çapında lider bir kurum olarak öne çıkmaktadır. Ancak, aldığı kararlar yalnızca ABD içerisinde bağlayıcılık taşırken, diğer ülkeler için önemli bir referans noktası ve rehber olarak işlev görür.
- FDA ilaç ve tıbbi cihazların güvenli ve etkili olduğundan emin olmak için titiz bir onay sürecine sahiptir.
- FDA onay süreci her zaman mükemmel değildir ve bazı ilaçlar veya cihazlar daha sonra piyasadan çekilebilir.
- Hekimlerinizle birlikte, her bir ilaç veya cihazın risklerini ve faydalarını tartarak tedavi kararları vermeniz önemlidir.
Ek Bilgiler
- Türkiye'de ilaç ve tıbbi cihazların onayı Türkiye İlaç ve Tıbbi Cihaz Kurumu (TİTCK) tarafından yapılmaktadır.
- TİTCK, FDA'ya benzer bir onay sürecine sahiptir.
- Hastalar, TİTCK'nın web sitesinden ilaç ve tıbbi cihazlar hakkında bilgi edinebilirler.
Dhruva SS, Kesselheim AS, Woloshin S, et al. Physicians’ perspectives on FDA regulation of drugs and medical devices: A national survey. Health Affairs. Published online January 8, 2024. doi:10.1377/hlthaff.2023.00466