Hodgkin Lenfoma Tedavisi İçin İmmünoterapi İlacı Pembrolizumab FDA Onayı Aldı
14 Mart 2017 tarihinde FDA, daha önce en az üç seri tedavi almış ve sonrasında nüksetmiş veya dirençli, klasik hodgkin lenfomalı hem erişkin hem pediatrik hastalar için pembrolizumaba (piyasa adı Keytruda®) hızlandırılmış prosedürle onay verdi.
FDA onayı, 210 erişkin klasik Hodgkin lenfomalı hastadan elde edilen verilere dayandırılmıştır. Çalışmaya daha önce otolog kök hücre nakli ve/veya brentuksimab vedotin ve ortalama dört seri sistemik tedavi sonrası, nüksetmiş veya dirençli hastalığı olan Hodgkin lenfomalı hastalar dahil edilmiştir. 9.4 aylık ortalama takip süresinde genel yanıt oranı % 69 olarak rapor edilmiştir. Tedavi yanıt oranlarının %47'si kısmi yanıt ve % 22'si tam yanıt olarak, tahmini ortalama yanıt süresi ise 11.1 ay olarak bulunmuştur. Pediatrik (çocuk) hastalarda etkinlik erişkinlerde gözlemlenen sonuçlardan çıkarılmıştır.
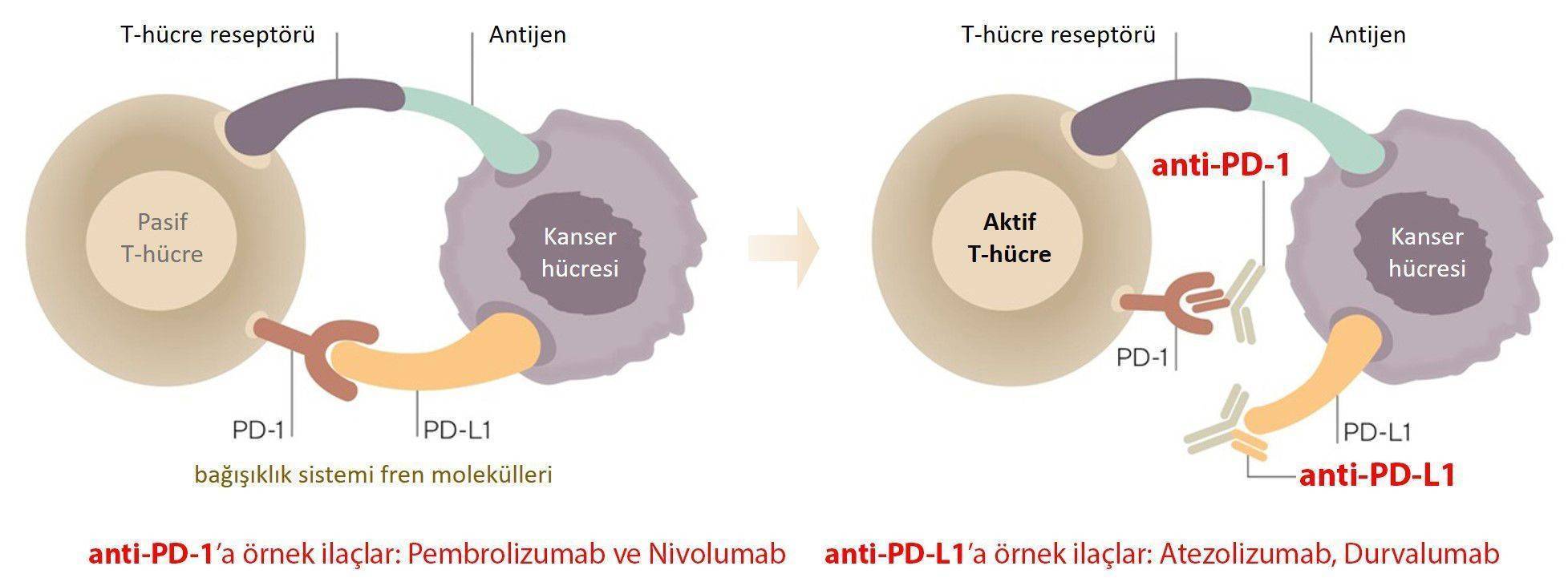
Yeni Nesil İmmünoterapi İlaçların Etki Mekanizmaları
Yetişkinlerde en sık görülen (hastaların en az % 20’inde görülen) yan etkiler yorgunluk, ateş, öksürük, kas iskelet sistemi ağrısı, ishal, döküntü ve karaciğer enzimlerinin yükselmesi olarak raporlanmıştır. Yaygın görülen (hastaların en az % 10’unda görülen) yan etkiler baş dönmesi, eklem ağrısı, kusma, mide bulantısı, kaşıntı, hipotiroidizm, üst solunum yolu enfeksiyonları, baş ağrısı, periferik nöropati, hiperbilirubinemi ve artmış kreatinin olarak bulunmuştur. Hastaların % 0.5-9'unda görülen immün aracılı yan etkiler ise infüzyon reaksiyonları, hipertiroidi, pnömoni, üveit, miyozit, miyelit ve miyokardittir.
İlaç güvenliği, ileri evre melanoma, PD-L1 pozitif solid tümörler veya lenfoma olan 40 çocuk hastada da değerlendirilmiştir. Pediatrik hastalardaki güvenlik profili erişkinlerde gözlemlenenlere benzer bulunmuştur. Çocuklarda yetişkinlerden daha yüksek bir oranda (% 15 veya daha fazla) ortaya çıkan yan etkiler yorgunluk, kusma, karın ağrısı, karaciğer enzimlerinin yükselmesi ve hiponatremi olarak bildirilmiştir.
FDA, pembrolizumab sonrası allojeneik hematopoietik kök hücre naklinin komplikasyonları için de yeni bir "Uyarı ve Önlem" ekledi. Transplantasyonlarla bağlantılı yaşam kayıpları meydana geldiği için sağlık profesyonellerinin, transplantasyona bağlı gelişebilen hiperakut graft versus host hastalığı (GVHD), grade 3ve 4 akut GVHD, steroid gerektiren ateş sendromu, hepatik veno-oklüzif hastalık (VOD) ve diğer immün aracılı advers reaksiyonların erken kanıtı için hastaları yakından takip etmeleri gerektiği bildirildi.
Klasik hodgkin lenfoma için pembrolizumabın önerilen dozu yetişkinlerde her üç haftada bir 200 mg'dır ve pediatrik hastalar için ise her üç haftada bir 2 mg / kg'dır (200 mg'a kadar).
FDA tarafından pembrolizumabın ergenlik öncesi çocuklarda kullanımı ve pembrolizumab sonrası allojeneik hematopoietik kök hücre transplantasyonunun güvenlik analizi çalışmalarının yapılmasına ihtiyaç olduğu bildirilmiştir.
Hematology/Oncology (Cancer) Approvals & Safety Notifications.
fda - gov






