
Kabozantinib, Pankreatik ve Ekstrapankreatik Nöroendokrin Tümörlerde FDA Onayı Aldı
Nöroendokrin tümör (NET) hastaları için sınırlı tedavi seçenekleri arasında umut verici bir gelişme yaşandı. ABD Gıda ve İlaç Dairesi (FDA), daha önce tedavi almış olan erişkin ve 12 yaş üzeri çocuklarda görülen iyi diferansiye pankreatik (pNET) ve ekstrapankreatik (epNET) nöroendokrin tümörlerin tedavisinde kabozantinib (Cabometyx) adlı ilacı 26 Mart 2025'te onayladı. Bu onay, özellikle ileri evre NET hastaları için yeni bir kapı aralıyor.
Nöroendokrin tümörler, son derece karma yapıdadır ve bu çeşitlilik, tedavi yaklaşımlarını zorlaştırır. Kabozantinibin, tümörün köken aldığı organdan ve tümör derecesinden bağımsız olarak hastalık ilerlemesini belirgin şekilde geciktirmesi, son derece umut verici.
Kimler İçin Onaylandı?
FDA’nın verdiği bu yeni onay, şu hasta gruplarını kapsıyor:
-
Cerrahi olarak çıkarılamayan (rezektabl olmayan)
-
Lokal olarak ilerlemiş ya da metastatik evredeki
-
Daha önce sistemik tedavi almış olan
-
İyi diferansiye pNET ve epNET hastaları
Yaş grubu açısından ise kabozantinib artık 12 yaş ve üzeri hem erişkin hem de pediatrik hastalar için kullanılabilecek.
CABINET Çalışması: Kabozantinib Etkinliğini Kanıtladı
FDA’nın bu onayı, kabozantinibin etkinliğini ortaya koyan randomize, plasebo kontrollü faz 3 CABINET çalışmasının verilerine dayanıyor. Çalışmada kabozantinibin, hastalığın ilerlemesini önemli ölçüde geciktirdiği görüldü.
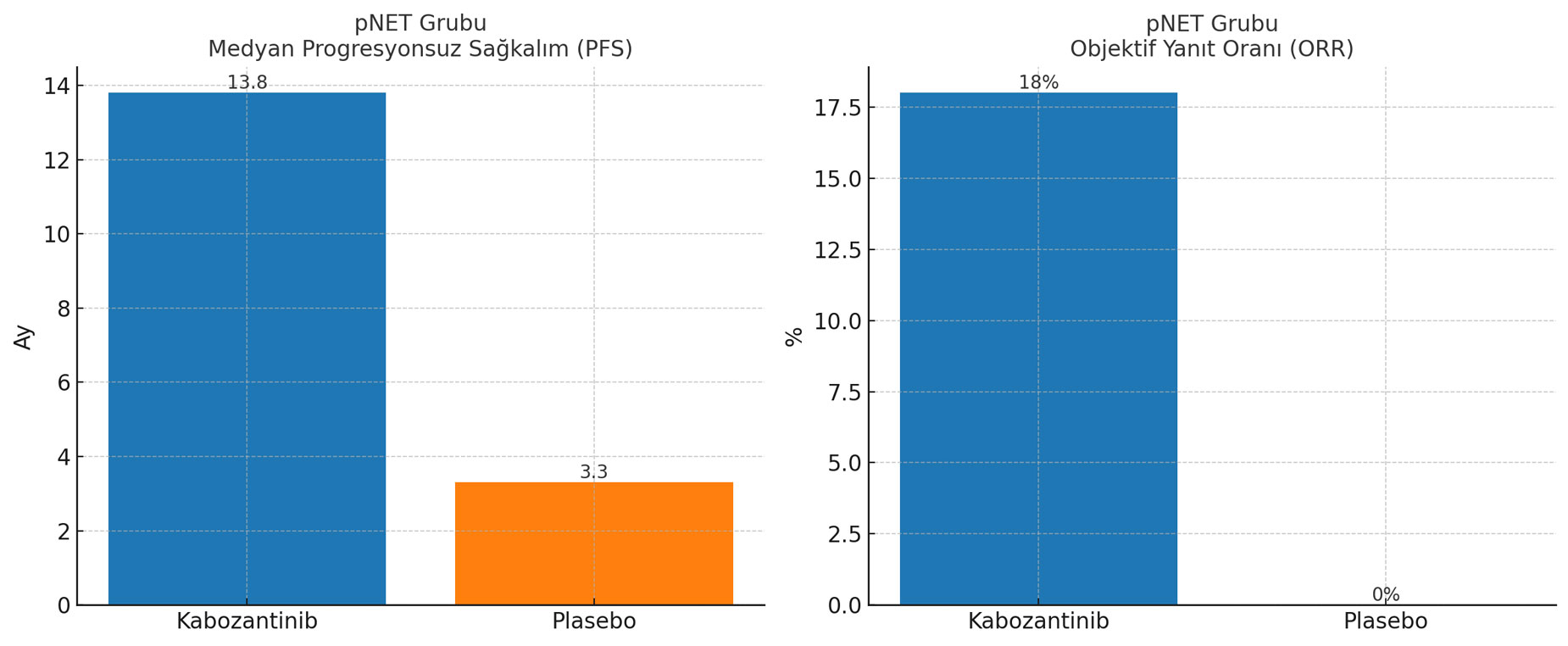
pNET Grubu Verileri
-
Toplam hasta sayısı: 99
-
Randomizasyon oranı: 2:1 (kabozantinib:plasebo)
-
Ortanca progresyonsuz sağkalım (PFS):
-
Kabozantinib kolunda: 13.8 ay
-
Plasebo kolunda: 3.3 ay
-
Kanserin ilerleme riskinde %78 azalma. Risk oranı (HR): 0.22
-
-
Objektif yanıt oranı (ORR):
-
Kabozantinib: %18
-
Plasebo: %0
-
Bu veriler, kabozantinibin plaseboya kıyasla hastalığın ilerlemesini %78 oranında azalttığını göstermektedir.
epNET Grubu Verileri
-
Toplam hasta sayısı: 199
-
Ortanca PFS:
-
Kabozantinib: 8.5 ay
-
Plasebo: 4.2 ay
-
HR: 0.40
-
-
ORR:
-
Kabozantinib: %5
-
Plasebo: %0
-
Bu da epNET hastalarında hastalık ilerlemesini yaklaşık %60 oranında geciktirdiğini ortaya koymaktadır.
Genel Sağkalım Henüz Olgunlaşmadı
Genel sağkalım verileri henüz yeterince olgunlaşmamış olmakla birlikte, çalışmada plasebo kolundaki hastaların önemli bir kısmı tedavi ilerledikçe kabozantinib koluna geçmiştir (crossover):
-
pNET kolunda %52
-
epNET kolunda %37
Bu durum, genel sağkalım analizlerinin yorumlanmasını bir miktar zorlaştırmaktadır.
Doz Bilgileri ve Güvenlik Profili
Dozaj:
-
Erişkinler ve ≥12 yaş çocuklar (≥40 kg): 60 mg/gün
-
≥12 yaş çocuklar (<40 kg): 40 mg/gün
Tedavi, hastalık progresyonu görülene kadar veya tolere edilemeyen yan etki gelişene dek devam eder.
Yan Etkiler
Kabozantinib, halihazırda böbrek hücreli kanser ve medüller tiroid kanseri dahil olmak üzere birçok endikasyonda onaylı bir ilaçtır. CABINET çalışmasında gözlenen yan etkiler, daha önce bilinen güvenlik profiliyle uyumlu bulundu. Yeni bir güvenlik sinyali saptanmadı.
SONUÇ: Nadir Ama Zorlu Tümörlere Karşı Etkili Bir Silah
Nöroendokrin tümörler, nadir görülmesine rağmen tedavisi zor ve yaşam kalitesini ciddi şekilde etkileyen kanser türlerindendir. FDA’nın kabozantinib için verdiği bu yeni onay, özellikle daha önce tedavi almış olan ve ileri evre hastalıkta olan bireyler için değerli bir tedavi seçeneği sunuyor. CABINET çalışmasının verileri, kabozantinibin hem pankreatik hem de ekstrapankreatik NET’lerde anlamlı klinik fayda sağladığını güçlü biçimde ortaya koyuyor.
FDA approves cabozantinib for adults and pediatric patients 12 years of age and older with pNET and epNET






