
KMT2A Translokasyonlu Relaps veya Refrakter Akut Lösemi İçin Revumenib FDA Onayı Aldı
FDA, 15 Kasım 2024'te, yetişkinler ve 1 yaş ve üzerindeki pediatrik hastalarda lysine methyltransferase 2A (KMT2A) gen translokasyonuna sahip relaps veya refrakter akut lösemi (R/R AL) için menin inhibitörü revumenibi (Revuforj, Syndax Pharmaceuticals, Inc.) onayladı.
Revumenib Neden Önemli? KMT2A Translokasyonlarının Sıklığı
KMT2A translokasyonları, akut löseminin yüksek riskli bir alt grubunda yer alır ve bu hastaların prognozu genellikle kötüdür.
-
Akut Lösemilerde Genel Oran:
- KMT2A translokasyonları, akut lösemilerin %5-10’unda görülür. Bu oran, lösemi alt tipine göre değişir:
- Akut Lenfoblastik Lösemi (ALL): Çocukluk çağı ALL'nin %5-10’u.
- Akut Miyeloid Lösemi (AML): Pediatrik AML'nin %15-20’si.
- Karma Hatlı Lösemiler (MPAL): KMT2A translokasyonları, karma lenfoid-miyeloid lösemilerde çok daha yaygındır.
- KMT2A translokasyonları, akut lösemilerin %5-10’unda görülür. Bu oran, lösemi alt tipine göre değişir:
-
KMT2A'nın Belirleyici Özellikleri:
- KMT2A, kromozom 11q23.3 konumunda yer alır ve şu ana kadar 112 farklı füzyon partneri tanımlanmıştır. Bu translokasyonlar farklı hastalık fenotiplerine yol açabilir (ALL, AML, MPAL).
- En sık kırılma bölgeleri, genin BCR1 (breakpoint cluster region 1) ve daha az sıklıkla BCR2 alanlarında yoğunlaşır.
-
Klinik Özellikler:
- KMT2A translokasyonu bulunan lösemi vakaları genellikle agresif bir seyir gösterir.
- Standart tedavilere direnç daha sık görülür ve bu da hedefe yönelik tedavileri (örneğin, menin inhibitörleri gibi) daha değerli hale getirir.
Revumenibin Etki Mekanizması
Revumenib, menin adı verilen bir proteini hedef alan bir inhibitördür. Bu ilaç, özellikle menin-MLL (KMT2A) füzyon proteini aracılığıyla gelişen akut lösemi hücrelerinin büyümesini ve çoğalmasını engeller. KMT2A translokasyonu, lösemi hücrelerinde genetik yeniden düzenlemeye neden olur ve bu durum, menin aracılığıyla lösemik genlerin sürekli olarak aktif hale gelmesine yol açar. Revumenib, bu süreci bloke ederek lösemik hücrelerin büyümesini durdurur.
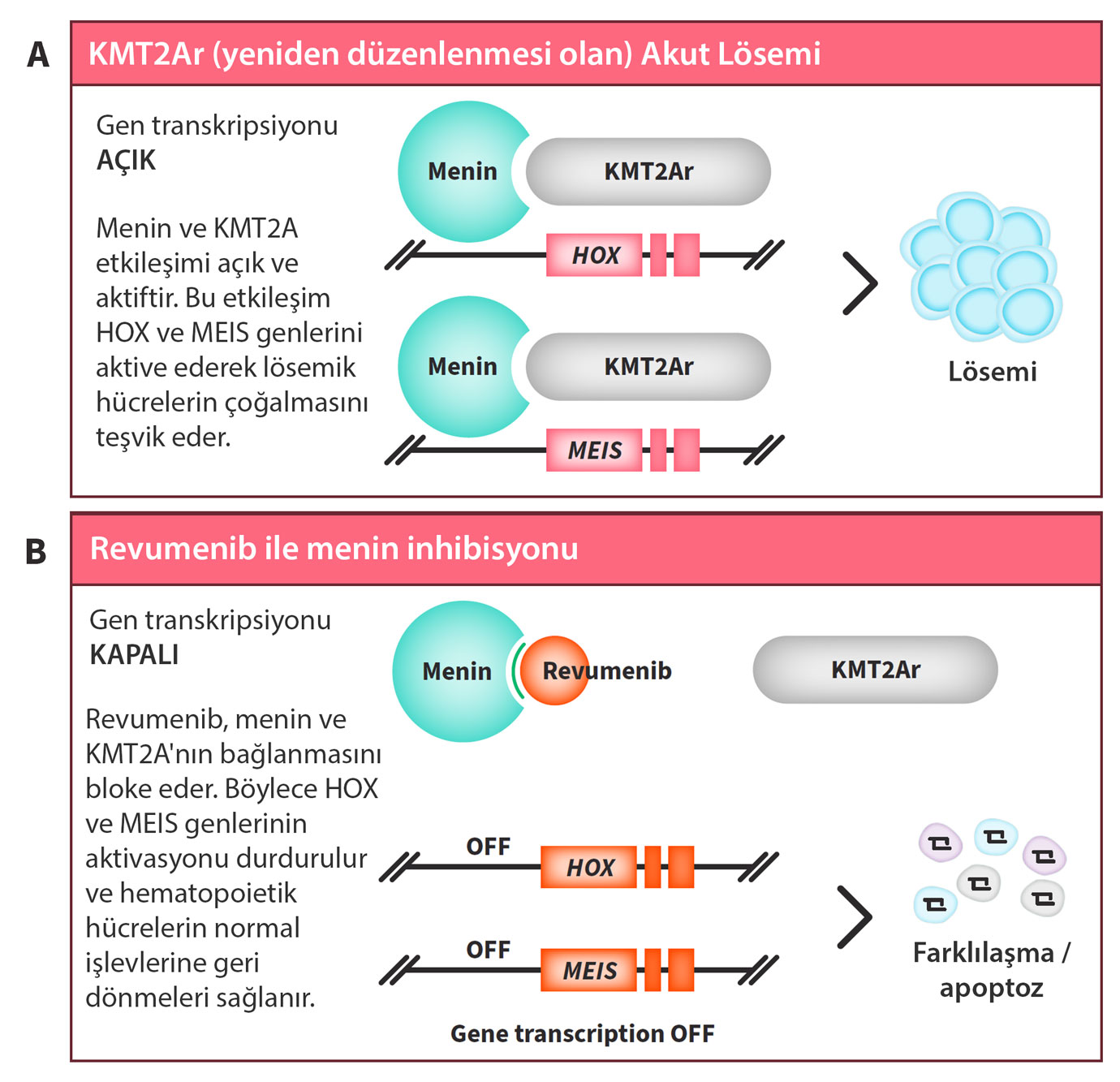
Menin Nedir?
Menin, hücre çekirdeğinde bulunan ve birçok genin ekspresyonunu düzenleyen bir proteindir.
- Normal rolü: Menin, genetik bilgiyi kontrol eden ve belirli proteinlerin üretilmesini düzenleyen menin-MLL kompleksinin bir parçasıdır.
- Lösemideki rolü: KMT2A (eski adıyla MLL) geninde meydana gelen translokasyonlar, anormal bir füzyon proteini üretir. Bu füzyon proteini menin ile bağlanarak, lösemi hücrelerinde normalde kapalı olan genlerin sürekli açık kalmasına neden olur. Bu durum, hücrelerin kontrolsüz şekilde büyüyüp çoğalmasına yol açar.
Menin’in Hedeflenmesi Neden Önemlidir?
- Spesifiklik: Menin inhibitörleri, yalnızca belirli genetik mutasyonları taşıyan lösemi hücrelerini hedef alır. Bu durum, sağlıklı hücrelere zarar verme riskini azaltabilir.
- KMT2A translokasyonunun etkisi: Bu translokasyon, pediatrik ve erişkin akut lösemi vakalarının yaklaşık %10'unda görülür ve standart tedavilere direnç gösterebilir. Menin inhibitörleri, bu hastalar için etkili bir tedavi seçeneği sunar.
Revumenib, menini hedefleyerek genetik temelli bir tedavi yaklaşımı sunar ve bu, lösemi tedavisinde önemli bir yenilik olarak değerlendirilir.
AUGMENT-101 Çalışmasıyla Gelen FDA Onayı
Revumenibin etkinliği, açık etiketli, çok merkezli bir klinik çalışmanın (AUGMENT-101, NCT04065399) tek kollu kohortunda değerlendirildi. Çalışmaya, relaps veya refrakter akut lösemisi olan ve KMT2A translokasyonuna sahip 104 yetişkin ve pediatrik hasta dahil edildi. Ana sonuç ölçütleri şunlardı:
-
Tam remisyon (CR) ve hematolojik kısmi iyileşme ile tam remisyon (CRh):
- Oran: %21,2 (95% CI: 13,8-30,3)
- Ortanca CR+CRh süresi: 6,4 ay (95% CI: 2,7, saptanamıyor)
- CR veya CRh'ye ulaşma süresi: 1,9 ay (aralık: 0,9-5,6 ay)
-
Transfüzyon bağımsızlığı:
- Çalışma başında kırmızı kan hücresi (RBC) ve/veya trombosit transfüzyonuna bağımlı olan 83 hastadan 12'si (%14) tedavi sırasında transfüzyon bağımsızlığı kazandı.
- RBC ve trombosit transfüzyonuna bağımsız olan 21 hastanın 10'u (%48) bağımsızlığını sürdürdü.
En Sık Görülen Yan Etkiler
Tedavi sırasında bildirilen en yaygın yan etkiler şunlardı (≥%20):
- Kanama, bulantı, kas-iskelet ağrısı, enfeksiyon
- Laboratuvar anormallikleri: Fosfat artışı, AST/ALT yükselmesi, potasyum düşüklüğü
- Klinik komplikasyonlar: Farklılaşma sendromu, febril nötropeni, QT uzaması
Dozlama ve Uygulama
Revumenibin dozu, hastanın vücut ağırlığına ve güçlü CYP3A4 inhibitörlerinin eş zamanlı kullanımına göre değişiklik göstermektedir. <40 kg ağırlığındaki hastalar için düşük doz formülasyonun ticari olarak hazır bulunamaması nedeniyle, bu grup için genişletilmiş erişim programı mevcuttur. Ayrıntılar için ilgili NCT05918913 çalışması incelenebilir.
FDA Onay Sürecinde Yenilikçi Yaklaşım
Bu onay, FDA’nın Gerçek Zamanlı Onkoloji İncelemesi (RTOR) pilot programı ve başvuruyu kolaylaştırmak için gönüllü olarak sunulan Değerlendirme Yardımı yöntemleri kullanılarak hızlandırılmıştır. Bu sayede, uygulamanın tamamlanması gereken tarihten 6 hafta önce onay verilmiştir.
Sonuç
Revumenib, KMT2A translokasyonuna sahip relaps veya refrakter akut lösemi hastaları için yenilikçi bir tedavi seçeneği sunarak bu zorlu hasta grubuna umut veriyor. Klinik veriler, hem etkinlik hem de güvenlik açısından anlamlı iyileşmeler gösteriyor. Ancak, tedavi sürecinde yan etkilerin dikkatle yönetilmesi önem taşımaktadır.
FDA approves revumenib for relapsed or refractory acute leukemia with a KMT2A translocation. 15 Nov 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-revumenib-relapsed-or-refractory-acute-leukemia-kmt2a-translocation






