
Nivolumab ve Relatlimab (Opdualag) Nedir? FDA Onayı, Türkiye Ruhsatı ve Geri Ödeme Durumu
- FDA Onayı: Evet (İlk onay tarihi: 18 Mart 2022)
- Ticari Adı: Opdualag
- Etken Maddeler: Nivolumab (PD-1 inhibitörü) ve Relatlimab (LAG-3 inhibitörü)
- Uygulama Şekli: İntravenöz infüzyon (damar içine uygulama)
- Sınıfı: İmmün kontrol noktası inhibitörleri (monoklonal antikorlar)
- Kategori: Antineoplastik / İmmünoterapi
- Üretici: Bristol Myers Squibb
- Türkiye Dağılımı: Türkiye'de henüz ruhsatlı değildir; ancak yurt dışı ilaç temini prosedürleriyle erişim sağlanabilir.
- Onaylı Olduğu Kanserler: 12 yaş ve üzeri çocuk ve yetişkinlerde, cerrahi olarak çıkarılamayan veya metastatik melanom tedavisi
Opdualag Nedir? Etki Mekanizması Nasıldır?
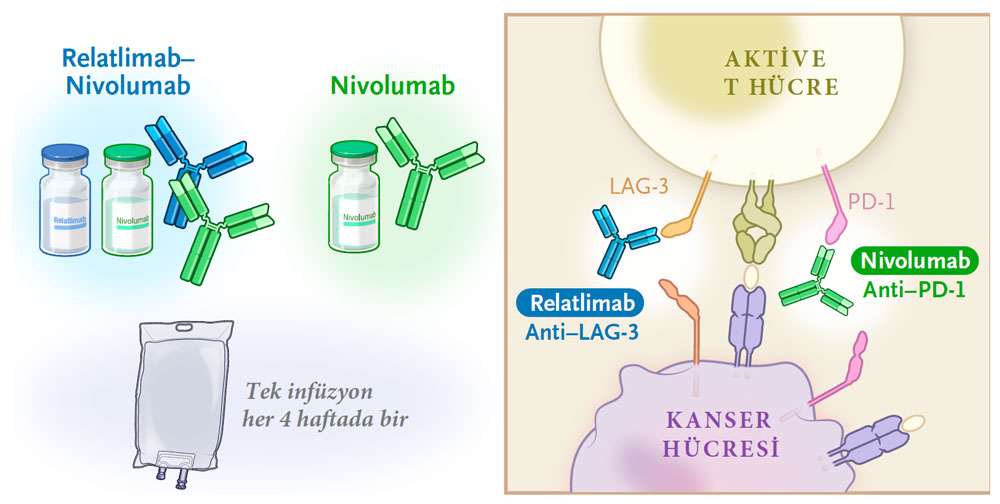
Opdualag, iki farklı immün kontrol noktası inhibitörünü (nivolumab ve relatlimab) bir araya getiren kombinasyon immünoterapi ilacıdır. Bu ilaç, bağışıklık sistemini aktive ederek vücudun kanser hücrelerini tanıyıp yok etmesini sağlar. Özellikle ileri evre (metastatik) veya cerrahi olarak çıkarılamayan malign melanom tedavisinde kullanılır.
Nivolumab, T hücreleri üzerinde bulunan PD-1 (Programmed Death-1) adlı reseptörü hedef alır ve tümörün bağışıklık sisteminden kaçma mekanizmasını bloke eder.
Relatlimab ise yine T hücre yüzeyindeki LAG-3 (Lymphocyte-Activation Gene 3) reseptörünü inhibe eder ve T hücrelerinin daha uzun süre aktif kalmasını sağlar.
Bu iki mekanizmanın eş zamanlı baskılanması, bağışıklık sisteminin kansere karşı daha güçlü ve etkili yanıt vermesine olanak tanır.
Etki Mekanizması Nasıldır?
PD-1 Blokajı (Nivolumab): Tümör hücreleri PD-L1 ligandı salgılayarak bağışıklık sistemini baskılar.Nivolumab, T hücresinin PD-1 reseptörünü bloke ederek bu baskıyı ortadan kaldırır ve bağışıklık sistemi yeniden aktive olur.
LAG-3 Blokajı (Relatlimab): Kronik uyarılma altındaki T hücrelerinde LAG-3 ekspresyonu artar ve T hücre yanıtı zayıflar. Relatlimab, LAG-3’ü hedef alarak T hücrelerinin işlevini sürdürmesine ve tümöre karşı daha kalıcı yanıt vermesine katkı sağlar.
Sinerjik Etki: PD-1 ve LAG-3 aynı anda baskılandığında, T hücre aktivitesi önemli ölçüde artar. Bu kombinasyon, yalnızca tek ajanla sağlanan etkinlikten daha yüksek klinik yanıtlar elde edilmesini sağlayabilir.
FDA (ABD Gıda ve İlaç İdaresi) Onay Tarihçesi
- 25 Mart 2021: Bristol Myers Squibb, daha önce tedavi edilmemiş metastatik veya cerrahi olarak çıkarılamayan melanom hastalarında anti-LAG-3 antikoru relatlimab ve Opdivo (nivolumab) kombinasyonunu değerlendiren RELATIVITY-047 çalışmasının, hastalıksız sağkalım (progression-free survival) açısından birincil sonlanım noktasına ulaştığını duyurdu.
- 20 Eylül 2021: ABD Gıda ve İlaç Dairesi (FDA), Bristol Myers Squibb’in cerrahi olarak çıkarılamayan veya metastatik melanom hastaları için relatlimab (LAG-3 bloke edici antikor) ve nivolumab’ın sabit doz kombinasyonu için yaptığı başvuruyu öncelikli inceleme kapsamında kabul etti.
- 18 Mart 2022: FDA, cerrahi olarak çıkarılamayan veya metastatik melanom tedavisinde Opdualag (nivolumab ve relatlimab-rmbw) kombinasyonunu onayladı.
Türkiye Ruhsatı
Türkiye'de henüz resmi olarak ruhsatlandırılmamıştır. Sağlık Bakanlığı'nın özel izin prosedürleri kapsamında yurt dışından temin edilebilir. TİCK yurtdışı ilaç listesinde bulunmamaktadır.
Direnç Mekanizması
- Tümör mikroçevresinde bağışıklık baskılayıcı hücrelerin artması: Tümör çevresinde regülatör T hücreler (Treg), miyeloid kaynaklı baskılayıcı hücreler (MDSC) ve tümörle ilişkili makrofajlar gibi bağışıklık baskılayıcı hücrelerin artışı, T hücrelerinin aktivitesini engelleyerek ilaca karşı direnç geliştirebilir.
- PD-L1 ve LAG-3 dışı bağışıklık kontrol noktalarının devreye girmesi: Opdualag yalnızca PD-1 ve LAG-3’ü hedefler. Ancak tümör hücreleri TIM-3, TIGIT gibi diğer immün baskılayıcı yolları aktive ederek bağışıklık sisteminden kaçabilir. Bu, tedaviye karşı ikincil (edinilmiş) direnç gelişmesine neden olabilir.
- Antijen sunumunda bozulma (MHC kaybı): T hücrelerinin tümör hücrelerini tanıyabilmesi için MHC sınıf I moleküllerinin düzgün çalışması gerekir. Eğer tümör hücreleri bu sistemi baskılar veya ortadan kaldırırsa, bağışıklık sistemi kanser hücresini tanıyamaz ve ilaç etkisiz hale gelir.
- T hücre yorgunluğu: Uzun süreli tümör varlığı, T hücrelerinde işlevsel tükenmeye neden olabilir.Bu durumda hücreler LAG-3 ve PD-1 baskılansa bile yeterli yanıt veremez.
- Tümörün immünolojik olarak “soğuk” hale gelmesi: Bazı tümörler, bağışıklık hücrelerinin infiltre olmasını engelleyerek “immün soğuk” bir yapı geliştirir. Bu durum, immünoterapilerin genel etkisini azaltır.
- Genetik evrim ve klonal seleksiyon: Bağışıklık sisteminden kaçabilen tümör alt klonları seçilir ve baskın hale gelir.Bu klonlar, artık mevcut immünoterapilere duyarsız hale gelmiş olabilir.
Emilim
- İntravenöz (IV) infüzyon.
- Bu nedenle klasik anlamda gastrointestinal emilim söz konusu değildir; ilaç doğrudan sistemik dolaşıma girer.
- Biyoyararlanımı %100 kabul edilir.
Dağılım
- Dağılım hacmi (Vd): Nivolumab için: Yaklaşık 8 L , Relatlimab için: Yaklaşık 6–8 L
- Bu değerler, bu antikorların esas olarak vasküler ve interstisyel sıvılarda dolaştığını gösterir.
- Plazma proteinlerine bağlanma: Monoklonal antikorlar yüksek oranda bağlanmazlar; spesifik reseptörlere hedeflenirler.
- Hedefe özgü dağılım: Nivolumab, T hücreleri üzerindeki PD-1 reseptörlerine bağlanır. Relatlimab, LAG-3 reseptörüne bağlanır.
- Dağılım, bu hedef reseptörlerin yoğun olduğu dokularda daha belirgindir (örneğin lenfoid dokular, tümör mikroçevresi).
Metabolizma
- Nivolumab ve Relatlimab, peptit yapılı büyük moleküller oldukları için klasik karaciğer metabolizmasına (CYP enzimleri) girmezler.
- Bunlar vücutta retiküloendotelyal sistem (makrofajlar, lizozomlar) tarafından yıkılır.
- Protein yapıları hücre içinde amino asitlerine kadar parçalanır ve vücut tarafından tekrar kullanılır veya atılır.
Atılım
- Böbrek veya safra yoluyla anlamlı atılım yoktur.
- Monoklonal antikorlar genellikle hepatik olmayan yollardan, yani hücre içi yıkım (katabolizma) ile ortadan kaldırılır.
- Nivolumab yarı ömrü yaklaşık 25 gün, Relatlimab yaklaşık 23 gün
- Bu uzun yarı ömürler, infüzyonların her 3 haftada bir yapılmasını mümkün kılar.
Doz Aralığı
- Tek dozluk bir flakon, 20 mL içinde 240 mg nivolumab ve 80 mg relatlimab içerir. 2 flakon Opdualag, 480 mg nivolumab + 160 mg relatlimab dozu için gereklidir.
- Uygulama Şekli; Her iki ajan, aynı infüzyon solüsyonu içinde sabit doz kombinasyonu halinde uygulanır.
- Her 4 haftada bir intravenöz infüzyon (yaklaşık 30 dakikalık uygulama)
- Genellikle sabit doz ile başlanır ve doz bireyselleştirme yapılmaz. Ancak ciddi advers reaksiyonlar gelişirse (örneğin, hepatit, kolit, nefrit, miyokardit gibi immün kaynaklı olaylar); Tedavi geçici olarak durdurulabilir.Şiddetli durumlarda kalıcı olarak kesilebilir
- Doz azaltımı uygulanmaz; yalnızca kesinti veya tedavi sonlandırma kararı alınır.
- Başka immünoterapiler veya hedefe yönelik tedavilerle birlikte kullanımı şu anda rutin klinik kullanımda önerilmez.
İlaç Etkileşimleri
- CYP450 ile İlişkili Etkileşim Beklenmez: Nivolumab ve Relatlimab, küçük moleküller gibi karaciğerin CYP450 enzimleriyle metabolize edilmez. Bu nedenle klasik ilaç–ilaç etkileşimleri (örneğin CYP3A4 inhibitörleri veya indükleyicileri ile) beklenmez.
- İmmünosupresif İlaçlarla Etkileşim: Kortikosteroidler (prednizon, deksametazon vb.) ve diğer bağışıklık baskılayıcı ilaçlar (örneğin siklosporin, azatioprin), immünoterapilerin etkinliğini azaltabilir.Ancak yüksek doz steroidler yalnızca ciddi immün yan etkiler geliştiğinde geçici olarak kullanılır.Düşük doz veya topikal steroidlerin Opdualag’ın etkisi üzerinde anlamlı bir etkisi olduğu düşünülmez.
- Canlı Aşılar ile Kullanım: İmmün sistemin yeniden aktive edilmesi nedeniyle, Opdualag tedavisi gören hastalara canlı atenüe aşılar (örn. kızamık, suçiçeği, BCG) uygulanmamalıdır.Aşı gerekiyorsa, immünoterapi başlamadan önce yapılmalı veya tedavi süresince ölü/inaktive aşılar tercih edilmelidir.
- Antikoagülan ve NSAİİ ilaçlar: Tek başlarına doğrudan etkileşim göstermezler ancak tedavi sırasında gelişebilecek immün kaynaklı enterit, kolit veya gastrit gibi yan etkiler varsa, mide mukozasını irrite eden ilaçlar (örneğin ibuprofen, aspirin) dikkatle kullanılmalıdır.
- Diğer İmmünoterapilerle Kombinasyon: Başka kontrol noktası inhibitörleriyle (örneğin ipilimumab) birlikte kullanım klinik çalışmalarda değerlendirilmekte olup, rutin uygulamada önerilmez.Kombinasyonların toksisite riskini artırabileceği unutulmamalıdır.
Dikkat Edilmesi Gereken Durumlar
İmmün kaynaklı organ toksisiteleri: Bağışıklık sisteminin fazla uyarılması, sağlıklı dokulara da saldırmasına neden olabilir. En sık etkilenen organlar:
- Cilt: Döküntü, kaşıntı, vitiligo
- Bağırsak: Kolit, ishal, karın ağrısı
- Karaciğer: Hepatit (AST/ALT yükselmesi)
- Akciğer: Pnömonit (kuru öksürük, nefes darlığı)
- Tiroid ve endokrin sistem: Hipotiroidi, hipofizit
Hafif vakalarda tedaviye devam edilirken semptomatik tedavi verilir. Ciddi vakalarda kortikosteroid ve/veya tedavi kesintisi gerekebilir.
Otoimmün hastalık öyküsü: Hastada daha önce var olan romatoid artrit, lupus, multipl skleroz gibi otoimmün hastalıklar varsa Opdualag tedavisiyle bu hastalıklar alevlenebilir.Bu hastalarda dikkatli izlem ve gerektiğinde diğer tedavi seçeneklerinin değerlendirilmesi önerilir.
Enfeksiyon riski: İmmün aktivasyon nedeniyle hastalar, fırsatçı enfeksiyonlara (özellikle akciğer, barsak, cilt) daha duyarlı hale gelebilir. Tedavi öncesinde aktif enfeksiyon varsa ertelenmelidir. Tedavi sırasında ateş, öksürük, ishal gibi belirtiler yakından takip edilmelidir.
Kortikosteroid kullanımı: Ciddi immün yan etkilerde kortikosteroid (örneğin prednizon) kullanılması gerekebilir. Ancak bu ilaçlar Opdualag’ın etkinliğini bir miktar azaltabilir.Sadece zorunlu durumlarda ve geçici olarak kullanılır.
Gebelik ve emzirme: Monoklonal antikorlar plasentayı geçebilir. Hayvan çalışmalarında fetal toksisite gözlenmiştir. Gebelikte kontrendikedir. Etkili doğum kontrolü önerilir. Emzirme döneminde de kullanılmamalıdır.
Canlı aşılar: Aktif immün sistemi tetikleyen aşılar (örn. kızamık, kabakulak, BCG) bu tedavi sırasında riskli olabilir. Canlı aşılar tedavi süresince yapılmamalıdır. İnaktive (ölü) aşılar tercih edilebilir.
Tedavi öncesi ve süresince düzenli izlem:
- Karaciğer fonksiyon testleri
- Tiroid hormon düzeyleri (TSH, fT4)
- Akciğer semptomları
- Cilt ve nörolojik durum
Bu testler, olası immün toksisitelerin erken tanısı için önemlidir.
Yan Etkiler
- Yorgunluk %18
- Kaşıntı (pruritus) %17
- Döküntü (dermatit) %13
- İshal %13
- Kas-eklem ağrısı (artralji / miyalji) %12
- Bulantı %11
- Baş ağrısı %10
- Tiroit disfonksiyonu (hipo/hipertiroidi)%9
- Karın ağrısı %9
- Kuru cilt %8
- Öksürük %7
- Ateş (pyreksi) %6
- Ağız kuruluğu %6
- Anemi %5
- Karaciğer enzim artışı (ALT/AST) %4
- Pnömonit (akciğer iltihabı) %2.5
- Kolit (bağırsak iltihabı) %2.3
- Hipofizit / adrenal yetmezlik %1.5–2
- Nefrit (böbrek iltihabı) %1






