Sınıfının İlk İlacı Tarlatamab, Küçük Hücreli Akciğer Kanserinde FDA Onayı Aldı
Platin bazlı kemoterapi sırasında veya sonrasında hastalığı ilerlemiş, yaygın evre küçük hücreli akciğer kanseri (KHAK) tedavisi için tarlatamab-dlle (Imdelltra, Amgen, Inc.), 16 Mayıs 2024'te hızlandırılmış FDA (ABD Gıda ve İlaç Dairesi) onayı aldı.
Sınıfının İlk Bispesifik (Çift-etkili) İlacı
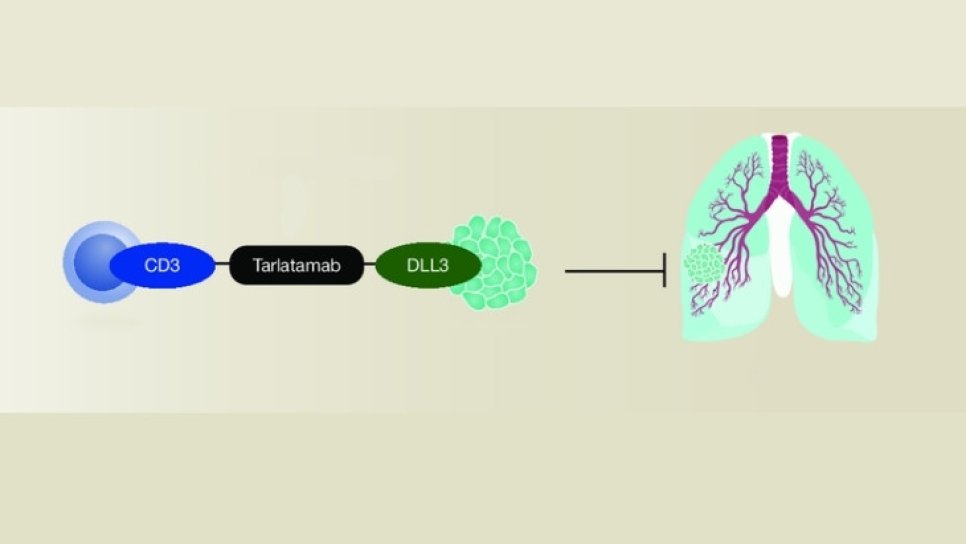
Sınıfının ilk bispesifik ilacı, daha önce benzer mekanizma veya hedeflerle geliştirilmemiş, yepyeni bir ilaç türü anlamına gelir. Tarlatamab-dlle, hem tümör hücrelerindeki DLL3 proteinine hem de bağışıklık sistemi hücrelerindeki CD3 proteinine aynı anda bağlanabilen ilk ilaçtır. Bu sayede bağışıklık sistemini aktive ederek tümör hücrelerini yok etmeyi hedefler. Bu çift hedefli yaklaşım, geleneksel tedavilere göre daha etkili ve daha az yan etki potansiyeli sunabilir. Bu anlamda tarlatamab, hedefe yönelik tedavi / akllı ilaç kapsamında değerlendirilir.
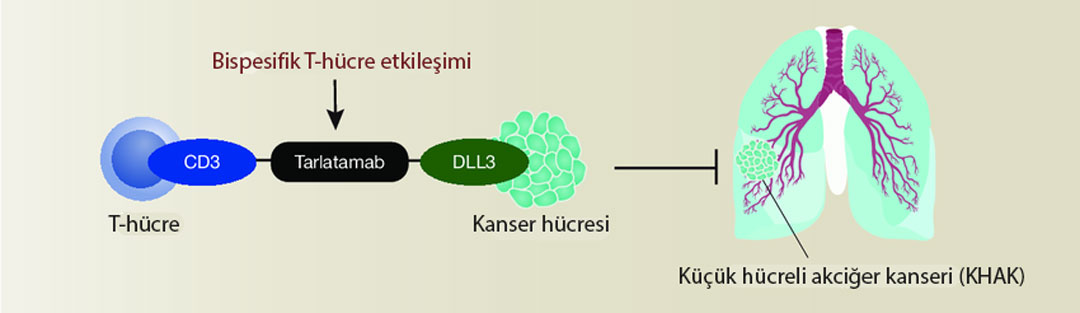
Tarlatamab, tümör hücreleri de dahil olmak üzere hücrelerin yüzeyindeki delta benzeri ligand 3'e (DLL3) ve T hücrelerinin yüzeyinde ifade edilen CD3'e bağlanan, sınıfının ilk örneği olan çift spesifik bir T hücresi aktive edicisidir (BiTE). Bu etkileşim, T hücresi aktivasyonuna, inflamatuar sitokinlerin salınımına ve DLL3 ifade eden kanser hücrelerinin parçalanmasına neden olur.
DeLLphi-301 Çalışması ile Gelen FDA Onayı
Etkinlik, açık etiketli, çok merkezli, çok kohortlu bir çalışma olan DeLLphi-301'e kayıtlı platin bazlı kemoterapi sonrasında hastalığı ilerlemiş, tekrarlayan/tedaviye dirençli yaygın evre KHAK'li 99 hastada değerlendirildi.
Belirti veren beyin metastazı, interstisyel akciğer hastalığı veya bulaşıcı olmayan pnömonit ve aktif immün yetmezliği olan hastalar çalışma dışı bırakıldı. Hastalara hastalık ilerlemesi veya kabul edilemez toksisiteye kadar tarlatamab verildi.
Başlıca etkinlik sonuç ölçütleri, genel yanıt oranı (ORR= overall response rate) ve yanıt süresi idi.
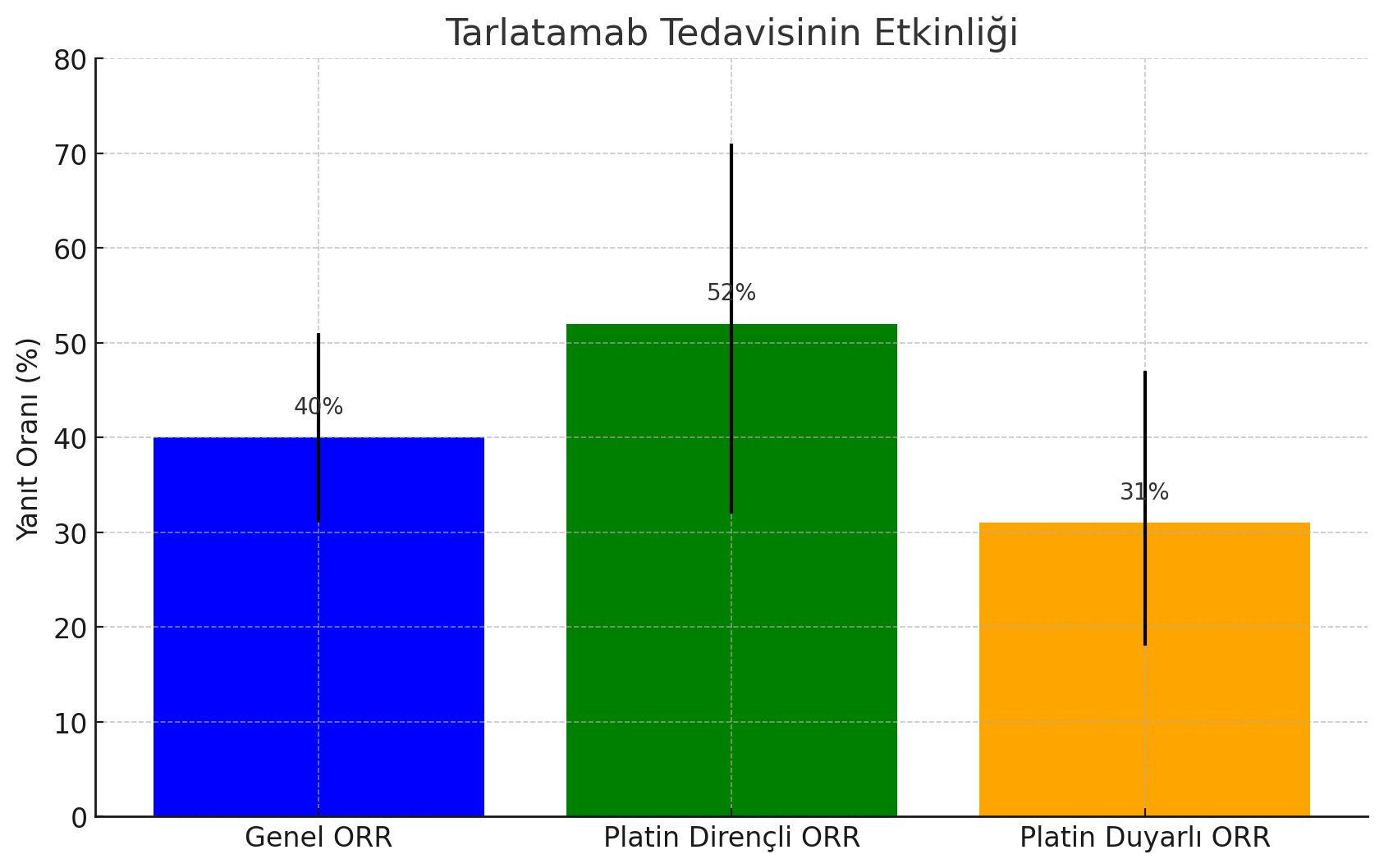
- Genel yanıt oranı %40 (95% CI: 31, 51) ve tedaviye yanıt evren hastalarda yanıtın ortanca süresi 9,7 ay (aralık 2,7, 20,7+) idi.
Platin duyarlılık durumu ile ilgili verilerin mevcut olduğu 69 hastanın genel yanıt oranı,
- platin dirençli KHAK'li 27 hastada %52 (95% CI 32, 71) (son platin tedavisi dozundan sonra < 90 gün içinde progresyon olarak tanımlanır) ve
- platin duyarlı KHAK'li 42 hastada %31 (95% CI 18, 47) idi (son platin tedavisi dozundan sonra ≥ 90 gün progresyon olarak tanımlanır).
Tarlatamab-dlle için reçete bilgileri, ciddi veya yaşamı tehdit eden sitokin salınım sendromu (CRS) ve bağışıklık efektör hücresi ilişkili nörotoksisite sendromu (ICANS) dahil olmak üzere nörolojik toksisite için bir Kutulu Uyarı içermektedir. En yaygın advers reaksiyonlar (%20'den fazla), sitokin salınım sendromu (CRS), yorgunluk, ateş, disgezi (tat alma bozukluğu), iştahsızlık, kas-iskelet ağrısı, kabızlık, anemi ve mide bulantısıydı. En yaygın Derece 3 veya 4 laboratuvar anormallikleri (≥%5), lenfositlerde azalma, sodyumda azalma, ürik asitte artış, toplam nötrofillerde azalma, hemoglobinde azalma, aktive parsiyel tromboplastin zamanında artış ve potasyumda azalma idi.
Önerilen tarlatamab dozu, 1. Döngü 1. Gün intravenöz infüzyon olarak 1 saatte uygulanan 1 mg'lık bir başlangıç dozu, ardından 1. Döngü 8. ve 15. Gün 10 mg, ardından hastalık ilerlemesine kadar veya kabul edilemez toksisiteye kadar her 2 haftada bir uygulanır.
FDA grants accelerated approval to tarlatamab-dlle for extensive stage small cell lung cancer. 16 May 2024 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-tarlatamab-dlle-extensive-stage-small-cell-lung-cancer






