Datopotamab deruxtecan ( Datroway) Nedir? FDA Onayı, Türkiye Ruhsatı ve Geri Ödeme Durumu
- FDA Onayı: Evet (İlk onay tarihi: 19 Nisan 2024)
- Ticari Adı: Datroway®
- Etken Madde: Datopotamab deruxtecan-dlnk (Bir antikor-ilaç konjugatı – ADC)
- Uygulama Şekli: İntravenöz infüzyon (damar yoluyla yavaş uygulama) , 6 mg/kg dozunda, her 21 günde bir uygulanır (her 3 haftada bir)
- Sınıfı: TROP2 hedefli antikor-ilaç konjugatı (ADC), DNA topoisomeraz I inhibitörü taşıyan monoklonal antikor
- Kategori: Hedefe yönelik antineoplastik (kanser tedavi edici) ajan
- Üretici: Daiichi Sankyo İş birliği ortağı: AstraZeneca
- Türkiye Dağılımı: Şu an itibarıyla Türkiye'de ruhsatlı değildir.
- Onaylı Olduğu Kanserler: Metastatik veya rezektabl olmayan hormon reseptörü (HR) pozitif, HER2 negatif meme kanseri. Daha önce sistemik tedavi (endokrin + kemoterapi) almış hastalarda kullanımı onaylanmıştır.
Datroway Nedir? Etki Mekanizması Nasıldır?
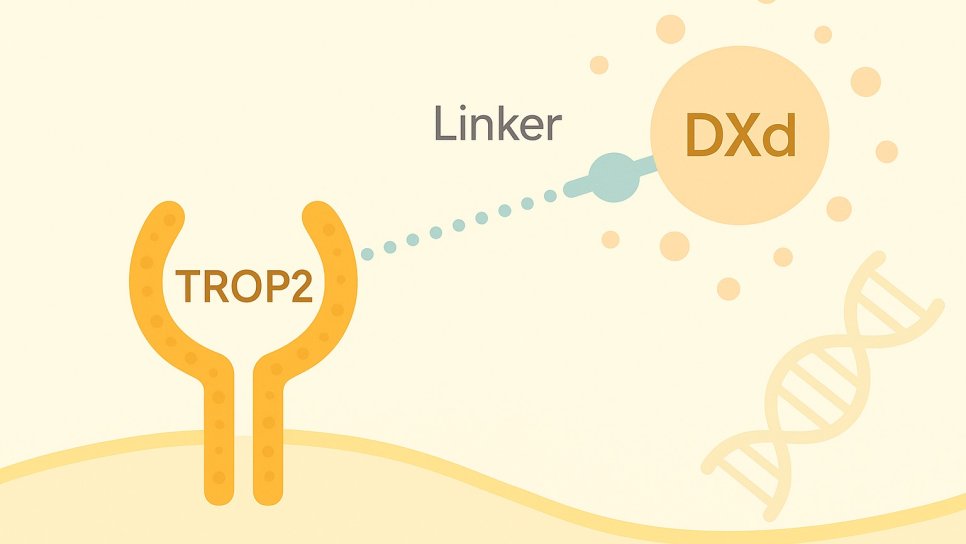
Etken maddesi datopotamab deruxtecan-dlnk olan ve TROP2 hedefli bir antikor-ilaç konjugatıdır. Bu ilaç, monoklonal antikor teknolojisiyle geliştirilmiş, spesifik tümör hücrelerine yönlendirilen bir kemoterapötik taşıyıcı sistem olarak görev yapar. ABD Gıda ve İlaç Dairesi (FDA) tarafından 2024 yılında, önceden sistemik tedavi almış olan hormon reseptörü (HR) pozitif, HER2 negatif, metastatik veya rezektabl olmayan meme kanseri tedavisi için onaylanmıştır.
Etki Mekanizması Nasıldır?
- TROP2'ye Yönelik Hedefleme: Datopotamab deruxtecan, TROP2'yi tanıyan bir monoklonal antikor içerir. Bu antikor, TROP2 proteini yüksek düzeyde ifade eden tümör hücrelerine bağlanır.
- Hücre İçi Alım ve Taşınma: Antikorun tümör hücresi yüzeyindeki TROP2'ye bağlanmasının ardından, bu kompleks hücre içine alınır ve lizozomlara taşınır.
- Sitotoksik Ajanın Salınımı: Lizozomlarda, tümör hücrelerine özgü enzimler tarafından, antikor ile bağlı olan DXd adlı güçlü bir topoisomeraz I inhibitörü serbest bırakılır.
- DNA Hasarı ve Hücre Ölümü: Serbest kalan DXd, DNA replikasyonu sırasında topoisomeraz I enzimini inhibe eder, bu da DNA hasarına ve sonuç olarak hücre ölümüne yol açar.
- Komşu Hücrelere Etki (Bystander Etkisi): DXd'nin hücre dışına sızabilme özelliği sayesinde, TROP2 ekspresyonu düşük olan komşu tümör hücreleri de etkilenebilir, bu da tümör mikroçevresinde geniş kapsamlı bir antitümör etki sağlar.
FDA (ABD Gıda ve İlaç İdaresi) Onay Tarihçesi
- 23 Haziran 2025: FDA, Datopotamab deruxtecan‑dlnk (Ticari adı: Datroway, DS‑1062a, Dato‑DXd) için hızlandırılmış onay verdi. Bu onay, ileri evre veya metastatik EGFR-mutasyonlu küçük hücre dışı akciğer kanseri hastalarında, daha önce EGFR hedefli tedavi ve platin bazlı kemoterapi almış yetişkinler için geçerlidir.
- 17 Ocak 2025: FDA, daha önce tedavi almış, metastatik HR pozitif, HER2 negatif meme kanseri hastaları için Datroway’i onayladı.
- 13 Ocak 2025: FDA, daha önce tedavi almış, EGFR mutasyonlu ileri evre küçük hücreli dışı akciğer kanseri (NSCLC) hastaları için öncelikli inceleme statüsü verdi.
- 12 Kasım 2024: EGFR mutasyonlu ileri evre NSCLC hastaları için hızlandırılmış onay başvurusu yapıldı.
- 23 Eylül 2024: TROPION-Breast01 Faz 3 çalışmasında, HR pozitif, HER2 düşük/negatif meme kanseri hastalarında genel sağkalım (OS) sonuçları bildirildi.
- 9 Eylül 2024: TROPION-Lung01 Faz 3 çalışmasında, gelişmiş NSCLC hastalarında 14.6 ay medyan sağkalım elde edildi.
- 8 Eylül 2024: Yeni bir TROP2 biyobelirteç (biyomarker), klinik başarıyı öngörmede etkili bulundu.
- 27 Mayıs 2024: Gelişmiş NSCLC hastalarında, DATROWAY, kemoterapiye kıyasla anlamlı genel sağkalım avantajı sağladı.
- 2 Nisan 2024: HR pozitif, HER2 negatif metastatik meme kanseri için biyolojik lisans başvurusu (BLA) ABD’de kabul edildi.
- 19 Şubat 2024: Gelişmiş NSCLC için ABD’de ikinci BLA başvurusu kabul edildi.
- 23 Ekim 2023: HR pozitif, HER2 düşük/negatif meme kanseri hastalarında da benzer progresyonsuz sağkalım başarısı elde edildi.
- 9 Aralık 2022: Metastatik üçlü negatif meme kanseri hastalarında monoterapi ve kombinasyon tedavileri umut verici sonuçlar verdi.
- 9 Ağustos 2022: İleri evre NSCLC hastalarında DATROWAY kombinasyonları olumlu klinik etkinlik gösterdi.
- 13 Haziran 2022: TROPION-Breast02 çalışması, metastatik üçlü negatif meme kanseri hastalarında başlatıldı.
- 18 Kasım 2021 : TROPION-Breast01 çalışması, HR pozitif, HER2 negatif metastatik meme kanseri hastalarında başlatıldı.
- 20 Eylül 2021: Genetik mutasyon taşıyan ileri evre NSCLC hastalarında olumlu tümör yanıtı bildirildi.
- 8 Mayıs 2021: ESMO 2021'de, DATROWAY ile tedavi edilen üçlü negatif meme kanserli hastalarda umut verici yanıt ve hastalık kontrolü gösterildi.
Türkiye Ruhsatı ve Geri Ödeme
Türkiye'de henüz bir ruhsatı bulunmamaktadır. Bu nedenle, Türkiye'de geri ödeme kapsamında değildir ve SGK tarafından karşılanmamaktadır.
Direnç Mekanizması
- TROP2 ekspresyon düzeyinin azalması veya kaybı: ADC'lerin seçici hedefi olan TROP2, tümör hücrelerinin yüzeyinde yeterli düzeyde bulunmazsa antikor kısmı hücreye bağlanamaz. Bu durumda tümör hücresi ADC’yi tanıyamaz ve endositoz gerçekleşmez ve ilacın hücre içine girişi engellenir. Bu tür direnç, genetik (mutasyon/susturma) ya da epigenetik mekanizmalarla TROP2 ekspresyonunun baskılanması sonucu gelişebilir.
- TROP2 internalizasyonunun bozulması: TROP2’ye bağlanma gerçekleşse bile reseptörün endositoz kapasitesi bozulmuşsa, ilaç hücre içine alınamaz. Bu durum, endositoz yolaklarının işlevsel bozukluğu nedeniyle gelişebilir.
- Bağlayıcı (Linker) Parçalanmasının Yetersizliği: Datopotamab deruxtecan, lizozomal ortamda pH’ye duyarlı enzimatik olarak parçalanabilir bir linker içerir. Eğer lizozomal asidik ortam bozulmuşsa linker parçalanamaz veDXd sitotoksik yük salınamaz. Bu, hücre içinde ilacın aktif formuna dönüşememesine neden olur.
- Topoizomeraz I İnhibisyonuna Karşı Direnç: Serbest kalan DXd, topoizomeraz I inhibitörüdür. DNA'nın süpercoil çözme işlevini engelleyerek DNA kırıklarına neden olur.
- İlaç Taşınım ve Effluks Mekanizmaları: Kanser hücreleri, toksik bileşenleri hücre dışına atan effluks pompalarını aşırı eksprese edebilir. Bu durum, DXd’nin hücre içinde yeterli konsantrasyona ulaşmasını engeller. ADC’ler, serbest bırakılan yük hücrede biriktiğinde etkili olur; effluks artışı ile bu avantaj kaybolur.
- Tümör Mikrosistemine Bağlı Etkenler: Hipoksi, asidik mikroçevre, stromal hücre engelleri ve immün kaçış mekanizmaları ADC etkinliğini azaltabilir. Ayrıca hücre dışı matriks bileşenleri, ADC'nin hücrelere ulaşmasını fiziksel olarak engelleyebilir.
Emilim
İntravenöz infüzyon yoluyla uygulanır; emilim aşaması bypass edilir. Sistemik dolaşıma doğrudan geçiş sağlanır, bu nedenle biyoyararlanımı %100’dür.
Dağılım
Konjugat formdaki antikor, düşük hacimde dağılım gösterir, çoğunlukla damar içi alanda kalır. DXd molekülü ise salındığında daha geniş bir dağılım gösterebilir. Plazma proteinlerine bağlanma oranı orta düzeydedir. TROP2 ekspresyonu yüksek olan tümör dokularına seçici olarak yönelir.
Metabolizma
Datroway (datopotamab deruxtecan-dlnk), bir antikor-ilaca konjugat olduğu için metabolizması üç bileşene göre değerlendirilir. Antikor kısmı (datopotamab), vücutta doğal antikorlar gibi hücresel enzimlerle parçalanarak aminoasitlere ayrılır. Linker adı verilen bağlayıcı yapı, sistemik dolaşımda stabil kalır ancak tümör hücresi içine girdikten sonra lizozomal enzimler tarafından parçalanarak sitotoksik ilaç olan DXd’yi serbest bırakır. DXd, karaciğerde CYP3A4 başta olmak üzere karboksilesterazlar ve diğer enzimler aracılığıyla metabolize edilir ve inaktif hale getirilir. Metabolitler genellikle idrar ve kısmen safra yoluyla atılır.
Doz Aralığı
- Önerilen standart doz: 6 mg/kg
- İntravenöz infüzyon şeklinde uygulanır.
- 3 haftada bir (her 21 günde bir) tekrarlanır.
- İlaç, hastalık progresyonu gözlenene veya tolere edilemeyen toksisite gelişene kadar uygulanabilir.
- Grade ≥2 interstisyel akciğer hastalığı veya ciddi advers olaylar gelişirse, doz azaltımı veya tedavi kesilmesi gerekebilir.
- Karaciğer yetmezliği olan hastalarda dikkatli olunmalı, yeterli veri bulunmadığı için bireysel değerlendirme yapılmalıdır.
- Vücut ağırlığına göre doz hesaplanır, sabit doz kullanılmaz.
İlaç Etkileşimleri
- CYP3A4 İnhibitör ve İndükleyicileri: DXd, karaciğerde CYP3A4 tarafından metabolize edilir. Güçlü CYP3A4 inhibitörleri (örn. ketokonazol, klaritromisin, itrakonazol) DXd maruziyetini artırabilir ve toksisite riski artar. Güçlü CYP3A4 indükleyicileri (örn. rifampisin, karbamazepin, fenitoin) DXd plazma düzeyini azaltabilir ve tedavi etkinliği düşebilir.
- P-glikoprotein (P-gp) Taşınımı Üzerinden Etkileşim: DXd'nin, P-gp substratı olabileceği düşünülmektedir. Güçlü P-gp inhibitörleri (örn. verapamil, amiodaron) hücre içi DXd düzeyini artırabilir. Bu durum özellikle toksisite potansiyelini artırabileceğinden klinik dikkat gerekir.
- Diğer Sitotoksik veya Myelosupresif Ajanlarla Kombinasyon: Datroway tek başına kullanılır, ancak diğer kemoterapötiklerle kombinasyon düşünülüyorsa; Kemik iliği supresyonu, trombositopeni, lökopeni gibi yan etkiler artabilir. Klinik olarak doz ayarlaması veya izlem gerekebilir.
- QT Uzaması Potansiyeli: DXd’nin doğrudan QT uzaması yaptığına dair güçlü veri yoktur, ancak diğer QT uzatıcı ilaçlarla (örn. sotalol, haloperidol, bazı makrolidler) birlikte kullanımda dikkatli olunmalıdır.
Dikkat Edilmesi Gereken Durumlar
- İnterstisyel Akciğer Hastalığı / Pnömoni: ADC sınıfının en ciddi ve potansiyel olarak ölümcül yan etkilerinden biridir.Klinik çalışmalarda İAH ve non-enfeksiyöz pnömoni vakaları gözlenmiştir. Hastalarda öksürük, dispne, ateş gibi belirtiler yakından izlenmelidir. Grade ≥2 İAH durumunda tedavi kesilmeli veya kalıcı olarak bırakılmalıdır.
- Miyelosupresyon (Kemik İliği Baskılanması): Nötropeni, anemi ve trombositopeni gelişebilir. Tedavi öncesi ve sırasında tam kan sayımı düzenli olarak takip edilmelidir. Ciddi hematolojik toksisitelerde doz azaltımı veya uygulama aralıklarının uzatılması gerekebilir.
- Gözle İlgili Yan Etkiler: Klinik çalışmalarda konjonktivit, kuru göz, bulanık görme gibi yan etkiler bildirilmiştir. Göz semptomları geliştiğinde göz doktoruna yönlendirme ve suni gözyaşı gibi destekleyici tedaviler önerilir.
- Ağız Mukoziti / Stomatit: Özellikle DXd bileşeniyle ilişkili olarak, mukozal tahriş ve ağrılı stomatit görülebilir. İyi ağız hijyeni, alkolsüz gargara ve gerekirse topikal ajanlarla semptomlar yönetilmelidir.
- Hipersensitivite Reaksiyonları: Antikor temelli ürünlerde nadir de olsa infüzyon ilişkili reaksiyonlar oluşabilir. İlk infüzyon sırasında hasta yakından izlenmeli; gerekirse pre-medikasyon (örn. antihistaminik) uygulanmalıdır.
- Hepatik Yetmezlik: DXd karaciğerde metabolize edilir; bu nedenle karaciğer fonksiyon bozukluğu olan hastalarda dikkatli kullanılmalıdır. Ciddi hepatik yetmezlikte veri sınırlıdır; bireysel değerlendirme gerekir.
- Böbrek Yetmezliği: Hafif-orta derecede böbrek yetmezliğinde doz değişikliği önerilmez. Ancak ileri evre böbrek yetmezliğinde yeterli veri yoktur; dikkatli olunmalıdır.
- Gebelik ve Emzirme: DXd, embriyotoksik ve fetotoksik etki potansiyeli taşır. Gebelikte kontrendikedir, tedavi süresince ve en az 7 ay sonrasına kadar etkili doğum kontrolü önerilir. Emzirme önerilmez; emziren annelerde ilaç kesilmeden emzirmeye devam edilmemelidir.
Yan Etkiler
- Mukozit / Stomatit %60–70
- Bulantı %55–65
- Yorgunluk / Halsizlik %40–55
- Kuru göz / Göz tahrişi %40–50
- Saç dökülmesi (alopesi)%30–40
- Gözde kaşıntı / rahatsızlık hissi %25–35
- Kusma %25–30
- Diyare (ishal) %20–30
- Anoreksi (iştahsızlık) %20–30
- Konjonktivit %20–25
- Nötropeni %15–20
- Trombositopeni %10–15
- Anemi %10–15
- Interstisyel akciğer hastalığı %3–8
- Pnömoni (non-enfeksiyöz) %2–5
- İnfüzyon reaksiyonları <%5






