FDA tarafından ilk Covid-19 aşı onayı verildi: BioNTech
Tarih boyunca halk sağlığı için atılan en önemli adımlardan biri…
28 Ağustos 2021’de FDA (ABD Gıda ve İlaç İdaresi) ilk Covid-19 aşı onayını verdi. Daha önce FDA, “acil kullanım izni” kapsamında bu aşıların kullanımını destekliyordu, şimdi ise ilk “düzenli onay” verildi. Uğur Şahin, Özlem Türeci ve ekiplerinin geliştirdiği Pfizer-BioNTech olarak bilinen aşı, şimdi 16 yaş ve üzeri kişilerde Covid-19 hastalığının önlenmesi için Comirnaty adıyla kullanılacak. Aşı ayrıca, 12 – 15 yaş arası çocuklar için ve bazı bağışıklık yetmezliği olan kişilerde üçüncü dozun uygulanması için acil kullanım izni kapsamında olmaya devam etmektedir.
Bir aşının FDA onaylı olması, bazıları için artık o aşıyı olmak için tam bir güven anlamına gelmekte
FDA yetkilisi Janet Woodcock, bu onay ile ilgili şunları söyledi: “FDA’nın bu aşıyı onaylaması, Covid-19 Pandemisi ile devam eden mücadelemizde bir dönüm notasıdır. Bu ve diğer aşılar, FDA onaylı ilk Covid-19 aşısı olarak acil kullanım izni için FDA’nın katı ve bilimsel standartlarını karşılamış olsa da halk, ayrıca bu aşının FDA’nın bir ürünü onaylaması için gerekli gördüğü yüksek güvenlik, etkinlik ve üretim kalitesi standartlarını karşıladığından çok emin olabilirler. Milyonlarca insan Covid-19 aşılarını güvenli bir şekilde yaptırmış olsa da bazıları için bir aşının FDA onaylı olmasının, artık o aşıyı olmak için tam bir güven anlamına geldiğini biliyoruz. Bugünkü dönüm noktası, bizi bu pandeminin gidişatını değiştirmeye bir adım daha yaklaştırıştır.”
11 Aralık 2020’den bu yana, Pfizer-BioNTech Covid-19 Aşısı, acil kullanım izni kapsamında 16 yaş ve üzeri kişilere uygulanmaktaydı ve yetkilendirme 10 Mayıs 2021’de 12 ila 15 yaş arasındaki çocukları kapsayacak şekilde genişletilmişti. FDA'nın, bir ürünün bilinen ve potansiyel faydalarının, hastalığı önlemek, teşhis etmek veya tedavi etmek için kullanıldığında, ürünün bilinen ve potansiyel risklerinden daha ağır bastığını belirlemesi koşuluyla, bir hastalığın önlenmesinde, teşhisinde veya tedavisinde etkili olabilecek tıbbi ürünlere erişim sağlamak adına halk sağlığı açısından acil durumlarda Acil Kullanım İzinleri, FDA tarafından kullanılabilir.
FDA onaylı aşılar, tıbbi ürünlerin kalitesini, güvenliğini ve etkinliğini gözden geçirmek için kurumun standart sürecinden geçer. Tüm aşılar için FDA, üreticinin biyolojik lisans başvurusu (BLB) sunumundaki verileri ve bilgileri değerlendirmektedir. BLB, kuruma sunulan ve çok özel gereksinimler sağlayan kapsamlı bir belgedir.
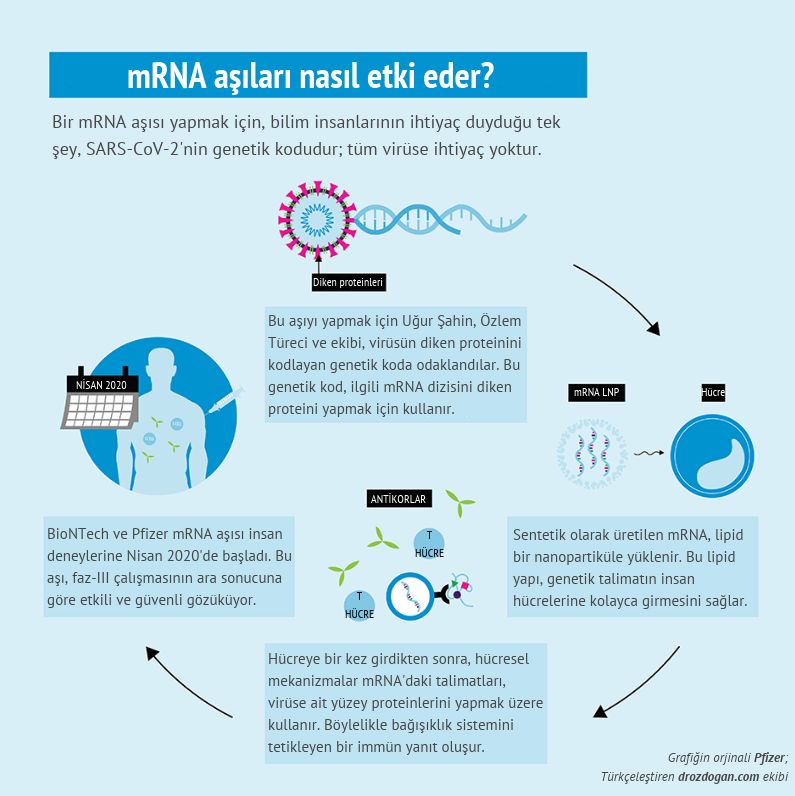
Comirnaty etki mekanizması nasıldır?
Comirnaty, bir tür genetik materyal olan mesajcı RNA (mRNA) içerir. Bu mRNA, Covid-19 hastalığına sebep olan virüsteki proteinlerden birini taklit etmek için vücut tarafından kullanılır. Bu aşıyı olan bir kişinin artık bağışıklık sisteminin Covid-19’a neden olan virüse karşı koruyucu bir şekilde tepki vermesi sağlanmış olur. Comirnaty’deki mRNA, vücutta yalnızca kısa bir süre bulunur ve bireyin genetik materyaline dahil edilmez ya da bireyin genetik materyalini değiştirmez. Comirnaty, Acil Kullanım İzni aşısı ile aynı formülasyona sahiptir ve üç hafta arayla iki dozluk bir seri olacak şekilde uygulanır.
FDA Biyolojik Değerlendirme ve Araştırma Merkezi başkanı Peter Marks hızlı bir şekilde onay alan aşı için şunları söyledi: “Bilimsel ve tıbbi uzmanlarımız bu aşının son derece kapsamlı ve dikkatli bir değerlendirmesini yaptı. Yüz binlerce sayfada yer alan bilimsel verileri ve bilgileri değerlendirdik, Comirnaty’nin güvenlik ve etkinliği için kendi analizlerimizi yaptık ve üretim tesislerinin denetimleri de dahil olmak üzere üretim süreçlerinin ayrıntılı bir değerlendirmesini yaptık. ABD’de Covid-19 halk sağlığı krizinin devam ettiğini ve halkın güvenli ve etkili aşılara güvendiğini de göz önünde bulundurduk. Halk ve tıp cemiyeti, bu aşıyı hızlı bir şekilde onaylamamıza rağmen ABD’deki aşılar için mevcut yüksek standartlarımızla tamamen uyumlu olduğundan emin olabilirler.”
16 yaş ve üzerine onay için güvenlik ve etkinlik verilerinin FDA değerlendirmesi
16 yaş ve üzeri bireylere yönelik Pfizer-BioNTech Covid-19 aşısı için 11 Aralık’ta yayımlanan ilk Acil Kullanım İzni, binlerce kişi üzerinde yürütülen randomize, kontrollü ve kör bir klinik araştırmanın güvenlik ve etkinlik verilerine dayanmaktaydı. FDA, bugünkü onay kararını desteklemek için Acil Kullanım İznini destekleyen ve daha büyük bir klinik araştırma popülasyonunda daha uzun bir takip süresi içeren klinik araştırmadan güncellenmiş verileri gözden geçirmiştir.
Özellikle onay için olan FDA incelemesinde kurum, ikinci dozdan sonraki bir hafta içinde Covid-19 virüs enfeksiyonuna dair bir kanıt olmayan, yaklaşık 20.000 aşı ve 20.000 plasebo olmuş 16 yaş ve üzeri kişilerin verilerini analiz etmişti. Comirnaty’nin güvenliği de 16 yaş ve üzeri yaklaşık 22.000 aşı olan ve 22.000 plasebo alan kişilerde değerlendirildi. Klinik araştırmanın sonuçlarına göre, aşı Covid-19 hastalığını önlemede %91 etkiliydi. Klinik deney katılımcılarının yarısından fazlası, ikinci dozdan sonra en az dört ay boyunca güvenlik sonuçları açısından takip edildi. Genel olarak, yaklaşık 12.000 kişi en az 6 ay boyunca takip edilmiştir.
Comirnaty olan klinik deney katılımcılarının bildirdiği en sık yan etkiler;
- Enjeksiyon bölgesinde ağrı, kızarıklık ve şişlik
- Yorgunluk
- Baş ağrısı
- Kas veya eklem ağrısı
- Titreme ve ateş
Aşı, Covid-19 hastalığını engellemede ve hastaneye yatış ve ölüm dahil olmak üzere potansiyel ciddi sonuçları önlemede etkilidir.
Ek olarak FDA, Pfizer-BioNTech COVID-19 aşısının uygulanmasının ardından miyokardit ve perikardite ilişkin yetkilendirme sonrası güvenlik gözetim verilerinin ince bir değerlendirmesini yaptı ve verilerin, özellikle ikinci dozu takiben yedi gün içinde artan riskler gösterdiğini belirlediler. 40 yaş altı erkeklerde gözlemlenen risk, kadınlara ve 40 yaş üstü erkeklere nazaran daha yüksektir. Gözlemlenen risk, 12 ile 17 yaş arasındaki erkeklerde ise en yüksektir. Kısa süreli takipten elde edilen mevcut veriler, çoğu kişinin belirtilerinin geçtiğini göstermiştir. Ancak bazı kişilerin de yoğun bakım desteğine ihtiyacı olmuştur. Potansiyel uzun vadeli sağlık sonuçları hakkında henüz bilgi mevcut değildir. Comirnaty Reçeteleme Bilgisi, bu riskler hakkında bir uyarı içermektedir. Bununla birlikte, Covid-19 hastalığının kendisi, mRNA aşılarının sebep olduğundan çok daha fazla miyokardit ve perikardite sebep olmaktadır.
Devam eden güvenlik takibi
FDA ve Hastalık Kontrol ve Önleme Merkezleri, herhangi bir güvenlik endişesinin zamanında tespit edilmesi ve değerlendirilmesinin devam edilmesini sağlamak için takip sistemleri mevcuttur. Ayrıca FDA, Comirnaty aşısını takiben miyokardit ve pedikardit risklerini daha fazla değerlendirmek için şirketin pazarlama sonrası için de çalışmalar yürütmesi şartını koymuştur. Bu çalışmalar, Comirnaty aşısı olduktan sonra miyokardit gelişen bireyler arasında uzun vadeli sonuçların bir değerlendirmesini içerecektir. Ek olarak, FDA gereklilikleri olmasa da şirket, gebelik sırasında Comirnaty aşısı olduktan sonra gebeliğin ve bebeğin sonuçlarını değerlendirmek için bir hamilelik kayıt çalışması yürütmek de dahil olmak üzere pazarlama sonrası ek güvenlik araştırmalarının taahhütünü vermiştir.
FDA Approves First COVID-19 Vaccine. 23 August 2021. aFDA: https://www.fda.gov/news-events/press-announcements/fda-approves-first-covid-19-vaccine






