Her şeyi değiştirecek! Google DeepMind yapay zekâsı protein yapılarını çözüyor
Bilim insanları, proteinlerin 3-boyutlu (3D) şekillerini saptamak için Google’ın derin öğrenme programlarının biyolojide köklü değişimler yapmak üzere olduğunu söylüyor. Yeni ilaç keşifleri konusunda bir devrimin eşiğindeyiz.
Google yapay zekasının yan ürünü DeepMind tarafından geliştirilen bir yapay zekâ ağı biyolojinin en büyük zorluklarından birini çözmede çok büyük bir adım attı – bir proteinin amino asit dizisinde 3D şeklini saptama.
AlphaFold adlı DeepMind algoritma programı, Critical Assessment of Structure Prediction’ın (Yapı Tahmininin Kritik Değerlendirilmesi) kısaltması CASP olarak adlandırılan biennial (iki yılda bir) bir protein yapısını tahmin etme zorluğunda diğer 100 takıma göre daha iyi performans gösterdi. Sonuçlar, 30 Kasım da bu yıl sanal olarak düzenlenen çalışmanın değerlendirildiği konferansın başında açıklandı.
Yukarıdaki şekil: 3D şekli ile tanımlanmış bir proteinin fonksiyonu – DeepMind.
1994’de protein yapılarının net bir şekilde tahminine hesaplamalı yöntemler geliştirmek için kurulan CASP’ın kurucusu ve aynı zamanda College Park’daki Maryland Üniversitesi’nde hesaplamalı biyolog olan John Moult “bu çok önemli bir iş” diyor.
Proteinlerin aminoasit dizilerinden yapılarını net bir şekilde tahmin etme yeteneği yaşam bilimleri ve tıp için büyük bir nimet olacak. Hücrelerin temel yapı taşlarını anlamak için büyük ölçüde hızlandıracak ve daha hızlı ve daha gelişmiş ilaç keşfine olanak sağlayacaktır.
Londra merkezli DeepMind’ın katıldığı ilk yıl olan 2018’deki son CASP’de AlphaFold masa başına geldi. Ancak bu yıl, ekibin derin öğrenme ağı diğer takımların çok üstündeydi ve bilim insanları, biyolojide bir devrimi müjdeleyebilecek kadar akıl almaz derecede iyi performans gösterdiğini söylüyorlar.
CASP’deki farklı ekiplerin performanslarını değerlendiren, Almanya Tübingen’deki Max Planck Gelişimsel Biyoloji Enstitüsü’nde evrimsel biyolog olan Andrei Lupas “Bu, oyunun kurallarını değiştiren bir gelişme” diyor. AlphaFold on yıldır Lupas’ın laboratuvarında canını sıkan bir proteinin yapısını bulmaya çoktan yardım etti ve ele aldığı sorularını ve çalışmalarını nasıl değiştireceğini bekliyor. Lupas “Bu, tıbbı değiştirecek. Araştırmayı değiştirecek. Biyomühendisliği değiştirecek. Her şeyi değiştirecek” diyor.
Bazı durumlarda, AlphaFold’un yapı tahminleri X-ışını kristalografii ve son yıllarda kriyo-elektron mikroskobu (kriyo-EM) gibi “altın standart” deneysel yöntemler kullanılarak saptananlardan ayırt edilemez. Bilim insanları AlphaFold’un bu zahmetli ve pahalı yöntemlere olan ihtiyacı – henüz – gideremeyebileceği söylüyorlar, fakat yapay zekâ canlılar ile yeni yollarda çalışmayı mümkün kılacaktır.
Proteinlerde yapı problemi
Proteinler, hücrelerin içlerinde olan olayların çoğundan sorumlu yaşamın yapı taşlarıdır. Bir protein nasıl çalıştığı ve ne yaptığı 3D şekli ile saptanır ve bir proteinin işlevini 3 boyutlu yapısı belirler. “Yapı işlevdir” sloganı, moleküler biyolojinin bir aksiyomudur. Proteinler yardımsız, sadece fizik kurallarının rehberliğinde şekil almaya eğilimlidirler.
Onlarca yıldır, laboratuvar deneyleri iyi protein yapıları elde etmek için ana yol olmuştur. Proteinlerin ilk tam yapıları, X-ray ışınlarının kristalize proteinlerde ateşlendiği ve kırılan ışığın bir proteini atomik koordinatlarına çevirdiği bir teknik kullanılarak 1950’lerin başlarında saptandı. X-ışını kristalografisi, aslanın protein yapılarının parçasını üretmiştir. Fakat son on yılı aşkındır, kriyo-EM birçok yapısal biyoloji laboratuvarının tercih ettiği bir araç oldu.
Bilim insanları bir proteinin bileşen parçalarını – bir dizi farklı amino asit – en son olan şeklinin birçok büklümü ve kıvrımını nasıl planladığını uzun süredir merak etmektedir. Araştırmacılar 1980’lerde ve 1990’larda protein yapılarını tahmin etmek için bilgisayarları kullanmaya yönelik ilk girişimlerin kötü sonuçlandığını söylüyor. Yayımlanmış makalelerdeki metotlara yönelik büyük iddialar, diğer bilim insanları onları diğer proteinlere uyguladığında parçalara ayrılma eğilimindeydi.
Moult, bu çabalara daha çok titizlik getirecek CASP’ı başlattı. Bu olay, ekipleri deneysel yöntemler kullanılarak çözülen fakat açıklanmayan proteinlerin yapılarını tahmin etmeleri için zorluyor. Moult, fazla abartılmış iddialar üzerine zaman arayarak, alanı büyük ölçüde düzeltme deneyine sahip olduğuna inanıyor. “Gerçekten neyin umut verici göründüğünü, neyin işe yaradığını ve neyden uzaklaşmanız gerektiğini anlıyorsunuz” diyor.
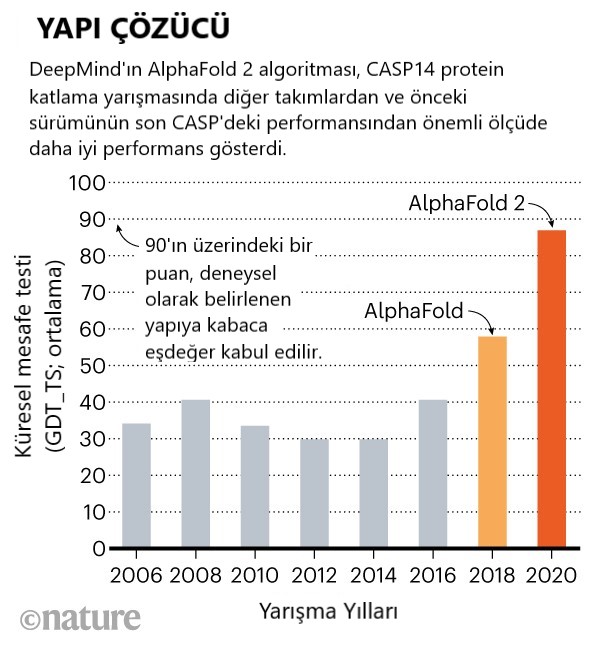
DeepMind’ın CASP13’teki 2018 performansı, uzun süredir küçük akademik grupların kalesi olan alandaki bilim insanlarını şaşırttı. Fakat Illinois Chicago Üniversitesi’nden hesaplamalı biyolog Jinbo Xu, yaklaşımının yapay zekâ uygulayan diğer ekiplerin yaklaşımına genel olarak benzediğini söylüyor.
AlphaFold’un ilk tekrarlaması bir proteindeki amino asit çiftleri arasındaki mesafeyi tahmin etmek için yapısal ve genetik verilere derin öğrenme olarak bilinen yapay zekâ yöntemini uyguladı. Projeye liderlik eden DeepMind’den John Jumper, yapay zekayı istemeyen ikinci bir adımda AlphaFold’un, proteinin neye benzemesi gerektiğine dair bir “fikir birliği” modeli bulmak için bu bilgiyi kullandığını söylüyor.
Ekip bu yaklaşımın üzerine eklemeler yaparak geliştirmeyi denedi fakat sonunda başarısız oldu. Jumper bu yüzden bu eklemenin değiştiğini ve bir proteinin nasıl katlandığını saptayan fiziksel ve geometrik kısıtlamalar hakkındaki ek bilgileri içeren bir yapay zekâ ağı geliştirildiğini söylüyor. Bunu da ayrıca daha zor belirlediler, görev: amino asitler arasındaki ilişkileri tahmin etmek yerine, ağ bir hedef protein dizisinin son yapısını tahmin eder. Jumper bunun “epeyce karmaşık bir sistem” olduğunu söylüyor.
Şaşırtıcı doğruluk
CASP birkaç ayda geçekleşir. Domain olarak adlandırılan hedef proteinler veya protein bölümleri – toplamda yaklaşık 100 – düzenli olarak serbest bırakılır ve ekiplerin yapı tahminlerini teslim etmek için birkaç haftaları vardır. Bağımsız bilim insanlarından oluşan bir ekip daha sonra tahmin edilen bir proteinin deneysel olarak saptanan yapıya ne kadar benzediğini ölçen ölçü bilimi kullanarak tahminleri değerlendirir. Değerlendiriciler kimin tahmin yaptığını bilmez.
Lupas, AlphaFold’un tahminleri “grup 427” adı altında geldi, fakat girişlerinin çoğunun şaşırtıcı doğrulukları onları öne çıkardı diyor ve ekliyor “AlphaFold olduğunu tahmin etmiştim. Çoğu kişi de tahmin etmişti”.
Bazı tahminler diğerlerinden daha iyiydi, ancak neredeyse üçte ikisi deneysel yapılarla kalite olarak karşılaştırılabilirdi. Bazı durumlarda AlphaFold’un tahminleri ile deneysel sonuç arasındaki uyuşmazlık bir tahmin hatası mı yoksa deneyin eseri mi olduğu net değildir diyor Moult.
AlphaFold tahminleri nükleer manyetik rezonans olarak adlandırılan bir teknik ile saptanmış deneysel yapılar ile zayıf eşleşmelerdi fakat bu, ham verilerin bir modele nasıl dönüştürüldüğüne bağlı olabilir diyor Moult. Ağ ayrıca protein komplekslerinde veya gruplarında tek tek yapıları modellemek için çabalar, bu sayede diğer proteinlerle etkileşimler şekillerini bozar.
Moult, son CASP’ye kıyasla bu yıl takımlar genel olarak yapıları daha kesin bir şekilde tahmin etti, fakat ilerlemenin çoğu AlphaFold’a bağlanabilir olduğunu söylüyor. Orta derecede zor olduğu düşünülen protein hedefleri üzerinde, diğer ekiplerin en iyi performansları genel olarak 100 üzerinden 75 puan alırken, AlphaFold aynı hedefler üzerinden yaklaşık olarak 90 puan aldı diyor Moult.
Yaklaşık olarak ekiplerin yarısının yaklaşımlarını özetledikleri özet kısımlarında derin öğrenmeden bahsettiğini söylüyor Moult ve yapay zekanın bu alanda geniş bir etki yarattığını öne sürüyor. Bunların çoğu akademik ekiplerdendi, fakat Microsoft ve Çin teknoloji firması Tencent de ayrıca CASP14’e girdi.
New York City deki Columbia Üniversitesi’nde hesaplamalı biyolog olan ve CASP katılımcısı olan Mohammed AlQuraishi, AlpaFold’un yarışmadaki performansının detaylarını incelemeye ve 1 Aralık da DeepMind ekibinin yaklaşımını sunduğu zaman sistemin nasıl çalıştığı hakkında daha fazlasını öğrenmek için istekli idi. AlQuarishi’nin güçlü önsezisi AlphaFold’un dönüşümsel olacağıdır.
“Bence bunun protein yapı tahmini alanında devimsel olduğu söylemek adildir. Çoğunun, ana problem tartışmalı bir şekilde çözüldüğü için alanı bırakacağından şüpheleniyorum. Bu, birinci dereceden bir buluştur ve kesinlikle hayatımın en anlamlı bilimsel sonuçlarından biridir” diyor.
Daha hızlı yapılar
Bir AlphaFold tahmini, Lupas’ın laboratuvarının yıllardır kırmaya çalıştığı bir bakteri proteininin yapısını saptamaya yardımcı oldu. Lupas’ın ekibi daha önce ham X-ışını kırılmasının verilerini toplamış fakat bu Rorschach benzeri modelleri bir yapıya dönüştürmek proteinin şekli hakkında bazı bilgiler gerektirir. Bu bilgiyi elde etmek için yapılan numaralar diğer tahmin araçları kadar başarısız oldu. Lupas “grup 427’deki model, her şeyi deneyerek on yıl harcadıktan sonra yarım saatte yapımızı bize verdi” diyor.
DeepMind’ın kurucu ortağı ve CEO’su Demis Hassabis, şirketin AlphaFold’u diğer bilim insanlarının kullanabilmesi için kullanışlı hale getirmeyi planladığını söylüyor (daha önce AlphaFold’un ilk sürümü hakkında diğer bilim insanlarının bu yaklaşımı kopyalaması için yeterince ayrıntı yayınlandı). Proteinin farklı bölgelerinin güvenirliği üzerine tahminler içeren tahmini bir yapının ortaya çıkması AlphaFold’un günlerini alabilir. İlaç keşfini ve protein tasarımını potansiyel uygulamalar olarak gören Hassabis “biyologların ne isteyeceğini anlamaya yeni başladık” diye ekliyor.
2020’nin başlarında şirket henüz deneysel olarak belirlenmemiş az miktarda SARS-CoV-2 protein yapılarının tahminlerini yayınladı. Berkeley’deki California Üniversitesi’nden moleküler nörobiyolog Stephen Brohawn’ın ekibi, Orf3a olarak adlandırılan bir protein için DeepMind’ın tahminlerinin daha sonra kriyo-EM aracılığı ile saptanana çok benzediğini haziran ayında açıkladı. “Yapabildikleri şey çok etkileyiciydi” diye ekliyor.
AlphaFold 2 algoritmasının, gerçek dünya etkisi nasıl olacak?
Proteinlerin evrimsel analizi gibi bazı uygulamalar gelişmeye hazırdır çünkü mevcut genomik veri dalgası artık güvenilir bir şekilde yapılara dönüştürülebilir. Lupas “bu, yeni nesil mikrobiyologlara daha gelişmiş sorular sormasına olanak sağlayacak” diyor. “Daha fazla düşünme ve daha az pipetaj gerektirecek”.
İngiltere Hinxton da Avrupa Moleküler Biyoloji Laboratuvarı – Avrupa Biyoinformatik Enstitüsü’nden yapısal biyolog ve eski CASP değerlendiricisi Janet Thornton “bu hayatımda çözülmeyeceğimi düşündüğüm bir sorun” diyor. Yaklaşımın insan genomundaki binlerce çözülmemiş proteinin işlevini aydınlatmaya yardımcı olabileceğini ve hastalık sebepli gen değişikliklerini anlamlandırabileceğini umut ediyor.
AlphaFold’un performansı ayrıca DeepMind için bir dönüm noktasını işaret eder. Şirket en çok, Go gibi oyunlarda ustalaşmak için yapay zekayı kullanması ile biliniyor, ancak uzun vadeli hedefi, geniş ve insan benzeri zekâ elde edebilme yeteneği olan programlar geliştirmektir. Hassabis, protein-yapı tahmini gibi büyük bilimsel zorlukların üstesinden gelmenin, yapay zekasının yapabileceği en önemli uygulamalardan biri olduğunu söylüyor. “Gerçek dünya etkisi açısından yaptığımız en anlamlı şey olduğunu düşünüyorum.”
Sonuç olarak yeni nesil birçok ilaç protein yapısındadır ve moleküler düzeyde genetik hedefler için doğru proteinleri üretmek bilim insanlarının mevcut koşullarda on yıllarını almaktadır. Google'ın derin öğrenme tabanlı AlphaFold 2 gibi algoritma programları ile, on yıllar aylara kısalabilir. Gelecek, biyoteknoloji alanında büyük heyecanlar barındırıyor.
*
Ewen Callaway. ‘It will change everything’: DeepMind’s AI makes gigantic leap in solving protein structures. 30 Nov 2020 Nature News