
HER2 Düşük ve Ultra-düşük Meme Kanseri İçin Enhertu FDA Onayı Aldı
Amerikan Gıda ve İlaç Dairesi (FDA), 27 Ocak 2025'te, HER2 düşük veya HER2 ultra-düşük, ameliyatla çıkarılamayan veya metastatik meme kanseri olan ve daha önce metastatik ortamda en az bir tür endokrin tedavi görmüş hastalar için trastuzumab derukstekan (T-DXd; Enhertu) onayını verdi.
Bu önemli karar, DESTINY-Breast06 faz 3 çalışmasının sonuçlarına dayanarak alındı. Bu çalışma, hormon reseptörü (HR) pozitif, HER2-düşük veya HER2 ultra-düşük ileri evre veya metastatik meme kanseri olan hastalarda T-DXd ile araştırmacının tercih ettiği kemoterapiyi karşılaştırdı.
FDA ayrıca Ventana'nın PATHWAY anti-HER-2 (4B5) Tavşan Monoklonal Primer Antikor testini, Enhertu ile tedavi için HER2-ultralow (membran boyama ile IHK 0) meme kanseri olan hastaları tanımlamak için bir yardımcı tanı cihazı olarak onayladı. Bu test daha önce Enhertu ile tedavi için HER2-low (IHK 1+ veya IHK 2+/FISH-) meme kanseri olan hastaları tanımlamak için onaylanmıştı.
HER2 Düşük ve HER2 Ultra-düşük: Ne Anlama Geliyor?
HER2 statüsü, meme kanseri hücrelerinde Human Epidermal Growth Factor Receptor 2 (HER2) proteininin miktarını ölçmek için kullanılan önemli bir biyobelirteçtir. HER2-düşük ve HER2-ultra-düşük, HER2 negatif meme kanseri alt gruplarını daha iyi anlamak ve tedavi seçeneklerini genişletmek için yapılan çalışmalarda ortaya çıkan yeni kategorilerdir. İşte bu sınıfların güncel tanımları:
HER2 Düşük (HER2-Low)
- Tanım: HER2 düşük statüsü, immünohistokimya (IHK) testinde HER2 proteininin 1+ veya 2+ olarak saptandığı, ancak in situ hibridizasyon (ISH) testinde HER2 gen amplifikasyonunun negatif olduğu durumdur.
- Klinik Özellikler: Bu grup genellikle hormon reseptörü (HR) pozitif olan hastaları içerir ve HER2 ekspresyonunun belirgin olduğu ancak pozitif kategorisine ulaşmadığı bir durumu ifade eder.
HER2 Ultra-Düşük (HER2-Ultralow)
- Tanım: HER2 ultra-düşük statüsü, HER2 proteininin tümör hücrelerinin yalnızca %10'undan azında zayıf veya tamamlanmamış membran boyamasıyla saptandığı durumdur. IHK 0 ve 1+ arası şeklinde düşünülebilir.
- Klinik Özellikler: HER2 ultra-düşük tümörler, genellikle HER2-düşük veya HER2-negatif (HER2-null) tümörlerden farklı klinikopatolojik özelliklere sahiptir. Örneğin:
- Daha yüksek Ki-67 proliferasyon indeksi (hızlı hücre çoğalması).
- Hormonal duruma göre değişen farklı cerrahi ve tedavi sonuçları.
HER2 Null
- Tanım: HER2 null, HER2 ekspresyonunun hiç saptanmadığı, yani hücrelerin HER2 boyaması göstermediği durumdur.
- Klinik Özellikler: HER2 null tümörler, HER2 ultra-düşük ve HER2-düşük tümörlere kıyasla daha az sıklıkla hormon reseptör pozitifliği gösterir.
DESTINY-Breast06 Çalışması ile Gelen FDA Onayı
Meme kanseri, dünya genelinde kadınlar arasında en sık görülen kanser olup, tedavi seçeneklerinin sürekli geliştirilmesi gerekliliğini ortaya koymaktadır. Trastuzumab derukstekan, şimdiye kadar yalnızca HER2-pozitif veya HER2-düşük tümörlerde etkinliği kanıtlanmış bir tedavi seçeneği olarak kullanılmıştır. Ancak, hormon reseptörü (HR) pozitif tümörlerde ve HER2-düşük ya da HER2 ultra-düşük ekspresyon gösteren hastalarda yeni olarak denenmekte olup, bu alanlardaki etkinliğini ortaya koyan çalışmalar sınırlıdır. Özellikle bu hasta gruplarında ilerleyen tedavi hatlarında etkili ve tolere edilebilir tedavilere duyulan ihtiyaç, bu çalışmayı kritik bir noktaya taşımaktadır.
Çalışma Tasarımı ve Yöntemler
DESTINY-Breast06 adlın bu faz III çalışmada, HR pozitif, HER2-düşük veya HER2 ultra-düşük metastatik meme kanseri olan ve en az bir endokrin tedavi sonrasında hastalık ilerlemesi yaşayan toplam 866 hasta rastgele iki gruba ayrıldı:
- Trastuzumab Derukstekan Grubu (T-DXd): Bu grup, antikor-ilaç konjugatı T-DXd ile tedavi edildi.
- Kemoterapi Grubu: Bu grup, doktorun tercihine göre seçilen standart kemoterapi tedavisi aldı.
Hastalar, daha önce hiç kemoterapi görmemişti ve endokrin tedaviye yanıtsızlık nedeniyle çalışmaya dahil edildi. Çalışma, T-DXd’nin progresyonsuz sağkalım (PFS) ve diğer tedavi sonuçları üzerindeki etkinliğini değerlendirdi.
Sonuçlar: Progresyonsuz Sağkalımda Belirgin Artış
Hastaların 713'ü HER2-düşük iken, 153'ü HER2 ultra-düşük meme kanserine sahipti.
Çalışma sonuçları, T-DXd'nin progresyonsuz sağkalımı (PFS) belirgin şekilde uzattığını ortaya koydu:
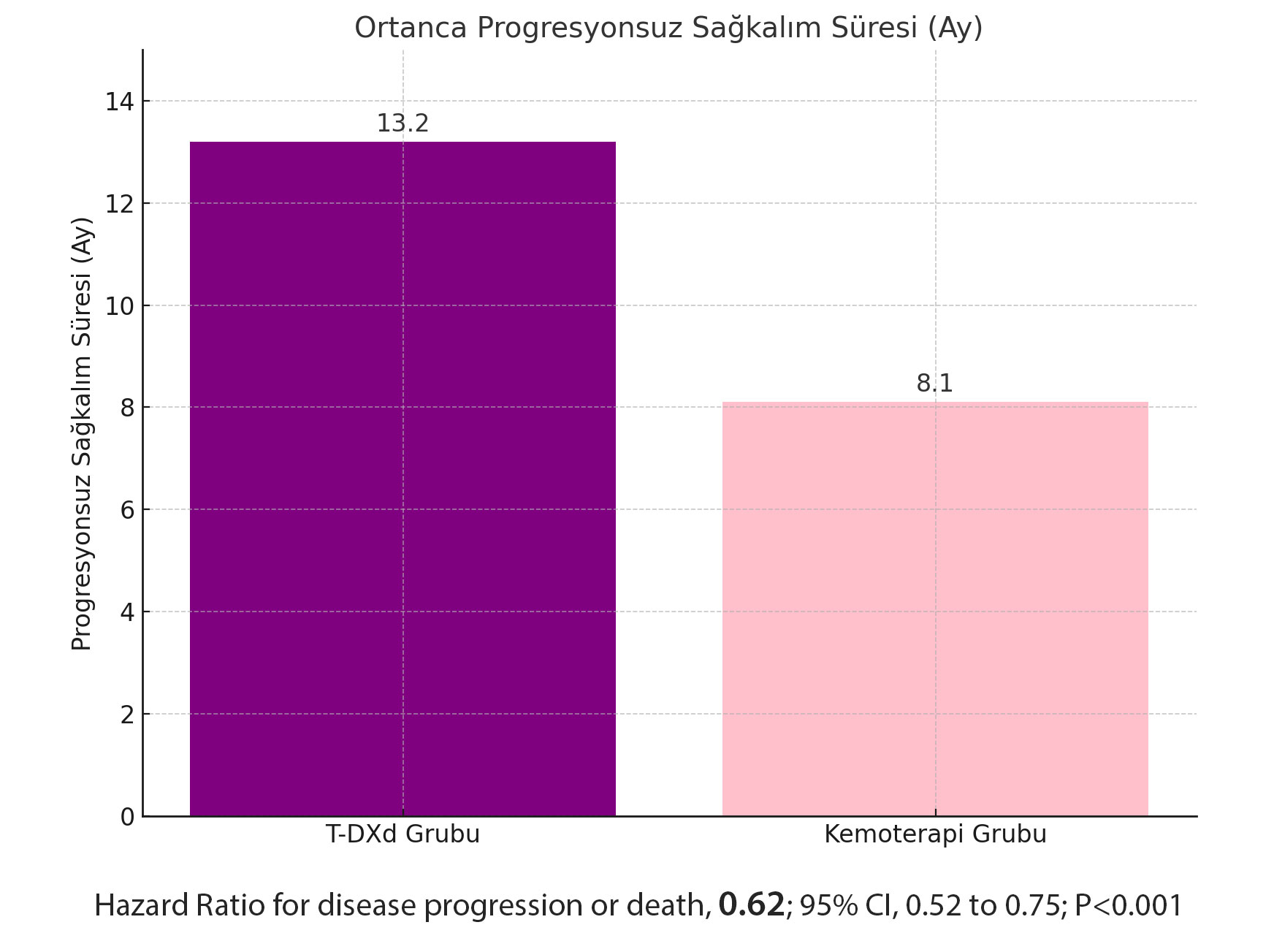
- T-DXd Grubu: Ortanca progresyonsuz sağkalım süresi 13.2 ay olarak hesaplandı.
- Kemoterapi Grubu: Ortanca progresyonsuz sağkalım süresi sadece 8.1 ay olarak belirlendi.
Bu bulgu, T-DXd’nin, kemoterapiye kıyasla kanserin ilerlemesini %38 azalttığını göstermektedir (hazard ratio for disease progression or death, 0.62; 95% CI, 0.52 to 0.75; P<0.001).
Ayrıca, T-DXd tüm hasta alt gruplarında – özellikle de endokrin tedavi sonrası hızlı progresyon gösteren (<6 ay) hastalarda – etkili bulunmuştur. Bu, ilacın geniş bir hasta grubu için umut vaat ettiğini kanıtlamaktadır.
Yan Etkiler
Trastuzumab derukstekan grubundaki hastaların %52,8’inde ve kemoterapi grubundaki hastaların %44,4’ünde 3. derece veya daha yüksek şiddette advers olaylar görülmüştür. İnterstisyel akciğer hastalığı (ILD) veya pnömonit, trastuzumab derukstekan grubunda 49 hastada (%11,3) meydana gelmiştir; bu olaylardan 3’ü 5. derece şiddetindedir. Buna karşılık, kemoterapi grubunda sadece 1 hastada (%0,2) 2. derece pnömonit bildirilmiştir.
FDA Approves T-DXd in HER2-Low/Ultralow Breast Cancer. January 27, 2025. By Ariana Pelosci. Fact checked by Russ Conroy. https://www.cancernetwork.com/view/fda-approves-t-dxd-in-her2-low-ultralow-breast-cancer






