Trastuzumab Derukstekan (Enhertu) Nedir? FDA Onayı, Türkiye Ruhsatı ve Geri Ödeme Durumu
- FDA (ABD Gıda ve İlaç İdaresi) Onaylı: Evet (İlk onay tarihi: 2019)
- Kutu Adı: Enhertu
- Etken Madde Adı: Trastuzumab deruxtecan
- Uygulama Şekli: İntravenöz (IV) yol ile uygulanır.
- Sınıfı: Antikor-ilaç konjugatı
- Kategori: Biyolojik yanıt değiştirici ajan/kemoterapi ilacı
- Üretici: Daiichi Sankyo
- Türkiye Dağıtımı: Daiichi Sankyo – AstraZeneca
- FDA Onaylı Olduğu Kanserler:
- Metastatik HER2-pozitif meme kanseri
- HER2-düşük pozitif meme kanseri
- HER2-pozitif gastrik ya da gastroözofageal bileşke adenokarsinomu
- HER2-mutasyonu pozitif metastatik küçük hücreli dışı akciğer kanseri (NSCLC)
Enhertu Nedir? Etki Mekanizması Nasıldır?
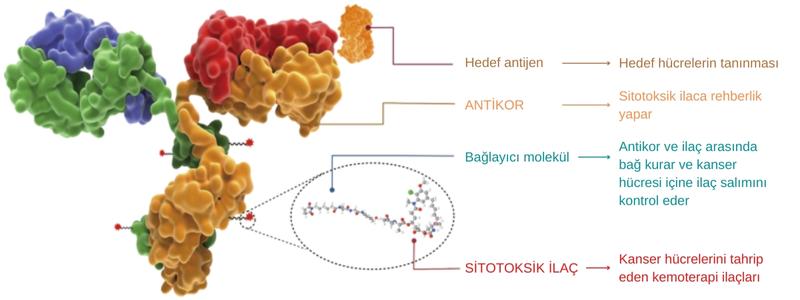
Enhertu, HER2 hedefli bir antikor-ilaç konjugatıdır. Trastuzumab deruxtecan, HER2 pozitif kanser hücrelerini hedef alır ve onları yok etmek için bir kemoterapi ajanı olan DXd'yi hücreye taşır. Bu ilaç, antikorun HER2 pozitif hücrelere bağlanmasının ardından hücre içine alınır, burada DXd serbest bırakılarak DNA sentezini ve hücresel bölünmeyi engeller, böylece kanser hücrelerinin ölmesine yol açar.
Trastuzumab deruxtecan, HER2 reseptörüne bağlanacak şekilde geliştirilen bir monoklonal antikor ve bu antikora bağlı bir kemoterapi ilacının birleşiminden oluşur. Antikor-ilaç konjugatı sınıfından yeni nesil kanser ilaçlarından biridir.
HER2, meme kanseri hücrelerinin yüzeyinde yoğun ya da az ifade edilen ve hem hastalık gidişatı hakkında fikir veren hem de akıllı ilaç hedefi olan bir reseptördür. 2000 yılı sonrası meme kanserleri HER2 pozitiflik durumuna göre sınıflandırılmaya başlanmıştır.

HER2-düşük Ne Demektir?
Tümör dokusu, patolog tarafından mikroskop altında incelenirken, özel immünohistokimyasal (İHK) boyamalarla, tümörün HER2 durumu tespit edilir. Artık klasikleşen yaklaşımımıza göre, İHK boyamalarda;
- 0 HER2 "negatif"
- 1+ HER2 durumu "düşük pozitif"
- 2+ HER2 durumu "şüpheli pozitif". Bu durumda doğrulama için FISH testi ile HER2 çalışılması gerekir. FISH pozitif ya da negatif saptanırsa tümörün HER2 yönünden nihai durumuna karar verilir.
- 3+ HER2 durumu ise "pozitif" kabul edilmektedir.
FDA (ABD Gıda ve İlaç İdaresi) Onay Tarihçesi
-
15 Ocak 2021: ABD'de daha önce tedavi görmüş HER2-pozitif ileri evre mide kanseri olan hastaların tedavisi için Enhertu onaylandı.
-
6 Ağustos 2022: HER2-düşük metastatik meme kanseri olan hastalar için Enhertu, ABD'de ilk HER2 hedefli tedavi olarak onay aldı.
- 27 Ocak 2024: HER2 düşük veya HER2 ultra-düşük, ameliyatla çıkarılamayan veya metastatik meme kanseri olan ve daha önce metastatik ortamda en az bir tür endokrin tedavi görmüş hastalarda onay aldı.
Türkiye Ruhsatı
Enhertu'nun ülkemizde T.C. Sağlık Bakanlığı ruhsatlı olduğu durumlar / terapötik endikasyonlar şu şekilde belirtilmiştir:
Meme kanseri
HER2 pozitif meme kanseri
Monoterapi olarak ENHERTU, cerrahi olarak çıkarılması mümkün olmayan veya metastatik hastalık için daha önce en az bir veya daha fazla taksan ve anti-HER2 bazlı rejim almış olan, aktif beyin metastazı olmayan, ECOG performans durumu 0 ve 1 olan yetişkin HER2 pozitif meme kanseri olan hastaların tedavisinde endikedir.
HER2 düşük meme kanseri
Monoterapi olarak ENHERTU, cerrahi olarak çıkarılması mümkün olmayan veya metastatik hastalık için daha önce kemoterapi almış veya adjuvan kemoterapi sırasında veya tamamlandıktan sonra 6 ay içinde hastalık nüksü gelişen, yetişkin metastatik HER2 düşük meme kanseri olan hastaların tedavisinde endikedir (bkz. Bölüm 4.2).
Küçük hücreli dışı akciğer kanseri (KHDAK)
Monoterapi olarak ENHERTU, tümörleri Exon 19 veya 20 aktive edici HER2 (ERBB2) mutasyonuna sahip ve immünoterapi ile birlikte veya immünoterapi olmadan en az bir basamak platin bazlı kemoterapiyi takiben sistemik tedavi gerektiren ileri evre Nonskuamöz KHDAK'li yetişkin hastaların tedavisinde endikedir.
Mide kanseri
Monoterapi olarak ENHERTU, daha önce trastuzumab bazlı bir tedavi rejimi almış olan ileri evre HER2 pozitif mide veya gastroözofageal bileşke (GEJ) adenokarsinomu olan yetişkin hastaların tedavisinde endikedir.
Geri Ödemesi Var mı?
Enhertu ülkemizde şu an eczanelerde bulunan bir ilaçtır. Bununla birlikte SGK geri ödemesi bulunmamaktadır.
Fiyatı: Eylül 2024 itibarıyla Enhertu 100 mg flakon eczane satış fiyatı: 33.547 liradır. Örneğin, 70 kilo meme kanserli hasta için bir seferde 378 mg gerekmektedir. Bu da bir tedavinin maliyetini 134.188 bin lira yapmaktadır.
Direnç Mekanizması
- HER2 reseptörünün azalması veya mutasyonlar
- Antikor-ilaç konjugatının zayıf internalizasyonu
- Lizozomal yıkımın azalması sonucu DXd serbest bırakılmasının yetersiz olması
- p95HER2 ekspresyonunun artması
Emilim
- İntravenöz yol ile uygulanır. Oral biyoyararlanımı yoktur.
Dağılım
- Plazma proteinlerine %97 oranında bağlanır.
Metabolizma
- Trastuzumab bileşeni karaciğer tarafından CYP3A4 enzimi aracılığıyla metabolize edilir.
- DXd'nin yarı ömrü yaklaşık 5,8 gündür.
Doz Aralığı
- Meme ve küçük hücreli dışı akciğer kanseri için önerilen doz: 5.4 mg/kg IV her 3 haftada bir.
- Gastrik kanser için önerilen doz: 6.4 mg/kg IV her 3 haftada bir.
- Enhertu’nun (trastuzumab deruxtekan) Tümör Agnostik Onayında Kullanılan Doz: 5.4 mg/kg IV, her 3 haftada bir (q3w)

İlaç Etkileşimleri
- Bilinen bir ilaç etkileşimi bulunmamaktadır.
Dikkat Edilmesi Gereken Durumlar
- Kalp yetmezliği riski nedeniyle sol ventrikül ejeksiyon fraksiyonu (LVEF) düzenli olarak kardiyolojik muayene ve EKO (kalp ultrasonu) ile takip edilmelidir.
- Pulmoner toksisiteye (zatürre) dikkat edilmelidir.
- Gebelik döneminde kullanılmamalıdır, doğum kontrol yöntemleri uygulanmalıdır.
- Ciddi karaciğer ve böbrek yetmezliği olan hastalarda dikkatle kullanılmalıdır.
Yan Etkiler
En sık olandan en seyrek olana göre yan etkiler şu şekilde bildirilmiştir:
- Pulmoner toksisite (pnömoni, nefes darlığı)
- İnfüzyon reaksiyonları
- Kardiyak toksisite (kardiyomiyopati)
- Miyelosupresyon (nötropeni ve anemi)
- Halsizlik, yorgunluk
- Bulantı, kusma ve iştah kaybı
Chu, Edward; DeVita Jr., Vincent T.. Physicians' Cancer Chemotherapy Drug Manual 2024.






