5 Nisan 2024'te, ABD Gıda ve İlaç Dairesi (FDA), daha önce sistemik tedavi görmüş ve tatmin edici bir alternatif tedavi seçeneği olmayan, ameliyatla çıkarılamayan veya metastatik HER2-pozitif (IHK3+) solid tümörleri olan yetişkin hastalar için fam-trastuzumab derukstekan-nxki etken maddeli Enhertu (Japon Daiichi Sankyo) adlı ilaca hızlandırılmış onay verdi.
Tümör Agnostik Tedavi nedir?
Tümör agnostik yaklaşımlar, kanserin köken aldığı doku ya da organı göz ardı ederek, tümörün genetik özelliklerini hedef alan tedaviler olarak tanımlanır. Tümör agnostik yaklaşımlar, onkoloji alanında devrim niteliğinde bir gelişme olarak kabul edilmektedir. Geleneksel kanser tedavileri genellikle kanserin tipine ve kökenine odaklanırken, tümör agnostik tedaviler, kanserin yerine genetik özelliklerini hedef alır. Bu strateji, belli biyolojik belirteçlere sahip olan tümörleri, onların vücuttaki konumlarından bağımsız olarak tedavi etmeyi amaçlar.
İlk tümör agnostik onayı 2017'de, yüksek mikrosatellit instabilitesi (MSI-H) veya eşleşmeyen tamir eksikliği (dMMR) gösteren tümörler için pembrolizumab (Keytruda) ile başlamıştır. O zamandan beri, bu alanda önemli ilerlemeler kaydedilmiştir.
Günümüzde,
- MSI-H/dMMR: MSI-H/dMMR için pembrolizumab (Keytruda). Sadece dMMR için dostarlimab (Jemperli)
- NTRK gen füzyonları: Larotektinib (Vitrakvi) ve entrektnib (Rozlytrek)
- Yüksek tümör mutasyon yükü (TMB-H): Pembrolizumab (Keytruda)
- BRAF mutasyonları: Dabrafenib (Tafinlar) ve trametinib (Mekinist)
- RET füzyonları: Selperkatinib (Retevmo)
- HER2-pozitif (IHK3+): Fam-trastuzumab derukstekan (Enhertu)
Böylece, karşılığjda FDA onayı tedaviler bulunan 6 farklı tümör agnostik biyobelirteç bulunmaktadır.
Trastuzumab Deruxtecan Etki mekanizması Nasıldır?
Enhertu, bilimsel adıyla trastuzumab deruxtecan, bir antikor-ilaç konjügatıdır (ADC= antibody drug conjugates). Bu ilacın etki mekanizması, iki önemli bileşeni birleştirerek çalışır: Bir antikor ve bir kemoterapi ilacı. Antikor, HER2 proteinini yüksek oranda ifade eden kanser hücrelerine özgüdür ve bu hücrelere hedeflenmiş bir şekilde bağlanır. Bu bağlanma, ilacın doğrudan kanser hücrelerine yönlendirilmesini sağlar.

Enhertu'nun içerdiği kemoterapi ilacı, topoisomerase inhibitörüdür. Antikor, Enhertu'yu HER2'yi yüksek oranda ifade eden kanser hücrelerine taşıdığında, kemoterapi ilacı hücre içine salınır. Bu ilaç, kanser hücrelerinin DNA'sına zarar vererek onların büyümesini ve çoğalmasını engeller. Ayrıca, bu ilaç hücre ölümüne yol açarak tümörün küçülmesine veya yavaşlamasına neden olabilir.
Hem antikor-ilaç konjugatları hem de tümör agnostik tedaviler, kanser tedavisinde kişiselleştirilmiş yaklaşımların önemli bir parçası haline gelmiştir.
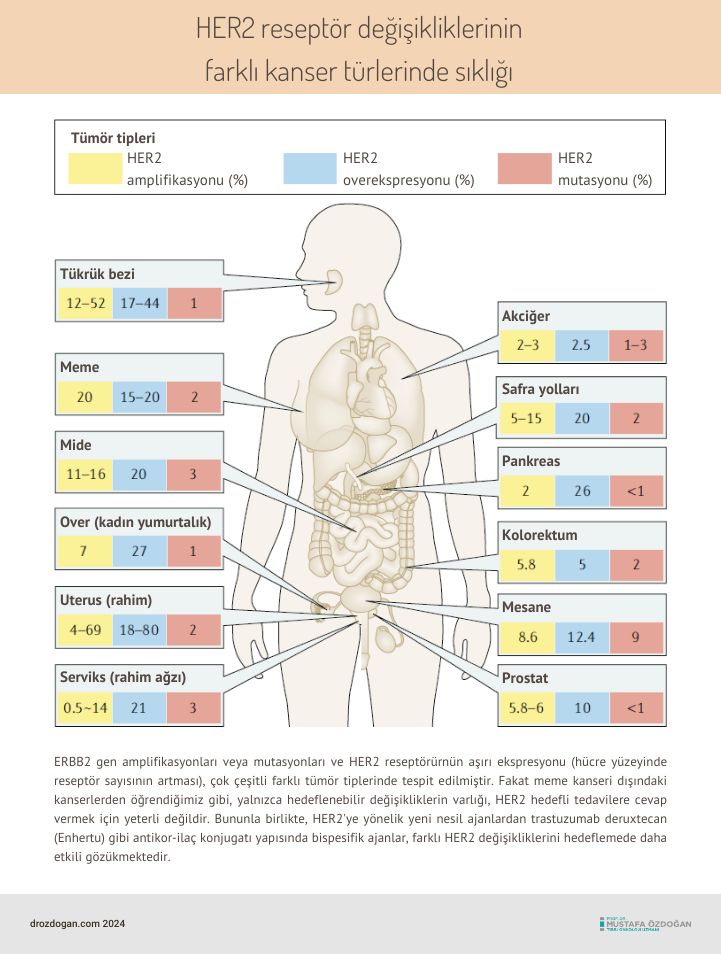
HER2 Değişiklikleri ve Kanserde Önemi
HER (İnsan Epidermal Büyüme Faktörü Reseptörü) ailesi, hücre büyümesi, farklılaşması ve hayatta kalmasını düzenleyen önemli sinyal yollarını etkileyen reseptör tirozin kinazlardan oluşur. Bu aile, özellikle kanserin gelişim ve ilerlemesinde merkezi bir rol oynar. HER ailesinin en çok incelenen üyelerinden biri olan HER2, bazı kanser türlerinde aşırı ifade edildiğinde (overekspresyon), hücrelerin kontrolsüz bir şekilde bölünmesine ve büyümesine yol açabilir. HER2, özellikle meme kanseri ve akciğer kanseri olmak üzere bir dizi kanser türünde önemli bir hedef moleküldür.
3 Çalışma ile Gelen FDA Onayı
Enhertunun etkinliği, daha önce tedavi görmüş, ameliyatla çıkarılamayan veya metastatik HER2-pozitif (IHK 3+) katı tümörleri olan 192 yetişkin hastada değerlendirildi.
Not: HER2-pozitif (IHK 3+), tümör hücrelerinin yüzeyinde HER2 proteininin yüksek düzeyde ifade edildiğini gösterir. Bu durum, patoloji uzmanları tarafından immünohistokimya (IHK) testi kullanılarak tespit edilir, bu test tümör dokusunda HER2 proteininin varlığını ve miktarını belirlemek için özel boyalar kullanır. IHK 3+ sonucu, tümör dokusunun yüzeyinde HER2 proteininin yoğun bir şekilde bulunduğunu ve bu nedenle HER2 hedefli terapilere yanıt verebileceğini gösterir.
Hastalar, üç çok merkezli denemeden birine kaydedildi:
- DESTINY-PanTumor02 (tüm solid tümörleri kaydetti),
- DESTINY-Lung01 (akciğer kanseri) ve
- DESTINY-CRC02 (kolorektal kanser).
Bu üç deneme, steroid ile tedavi gerektiren veya tarama sırasında intersitisyel akciğer hastalığı/pnömoniti olan ve klinik olarak önemli kalp hastalığı geçmişi olan hastaları hariç tuttu. Ayrıca, aktif beyin metastazı veya ECOG performans durumu >1 olan hastalar da dahil edilmedi.
Tedavi, hastalık ilerlemesi, yaşam kaybı, hastanın deneme onayını geri çekmesi veya kabul edilemez toksisiteye kadar verildi.
Üç denemede de ana etkinlik sonuç ölçütü teyit edilmiş objektif yanıt oranı (ORR) idi ve ek bir etkinlik sonucu yanıt süresi (DOR) idi. Tüm sonuçlar, bağımsız merkezi inceleme (ICR) tarafından RECIST v1.1'e göre değerlendirildi.
- DESTINY-PanTumor02'de objektif yanıt oranı %51.4 (95% CI: 41.7, 61.0) ve ortanca yanıt süresi 19.4 aydı (aralık 1.3, 27.9+).
- DESTINY-Lung01'de ORR %52.9 (95% CI: 27.8, 77.0) ve ortanca yanıt süresi 6.9 aydı (aralık 4.0, 11.7+).
- DESTINY-CRC02'de ortanca yanıt oranı %46.9 (95% CI: 34.3, 59.8) ve ortanca yanıt süresi 5.5 aydı (aralık 1.3+, 9.7+).
En yaygın (≥%20) advers reaksiyonlar, laboratuvar anormallikleri dahil, beyaz kan hücresi sayısında azalma, mide bulantısı, hemoglobin azalması, nötrofil sayısında azalma, yorgunluk, lenfosit sayısında azalma, trombosit sayısında azalma, aspartat aminotransferaz (AST) artışı, alanin aminotransferaz (ALT) artışı, kan alkalen fosfataz (ALP) artışı, kusma, iştah azalması, alopesi, ishal, kan potasyumunda azalma, kabızlık, sodyumda (Na) azalma, stomatit ve üst solunum yolu enfeksiyonuydu. Reçete bilgisi, sağlık profesyonellerini interstisyel akciğer hastalığı ve embriyo-fetal toksisite riski konusunda uyaran bir Kutulu Uyarı içerir.
Bu endikasyon için önerilen fam-trastuzumab derukstekan-nxki dozu, hastalık ilerlemesi veya kabul edilemez toksisiteye kadar her 3 haftada bir (21 günlük siklus) intravenöz infüzyon olarak 5.4 mg/kg'dır.
Bu tümör agnostik endikasyon, objektif yanıt oranı ve yanıt süresine dayanarak hızlandırılmış onay altında onaylanmıştır. Bu endikasyon için devam eden onay, teyit edici deneme(ler)de klinik faydanın doğrulanması ve tanımlanmasına bağlı olabilir.
Sonuç
FDA'nın, tam etken madde ismi "fam-trastuzumab derukstekan-nxki" olan Enhertu ilacına hızlandırılmış onay vermesi, kanser tedavisinde önemli bir dönüm noktasını işaret ediyor. Bu onay, tedavi seçenekleri sınırlı olan ve daha önce sistemik tedavi görmüş, ancak bu tedavilere yeterli yanıt alamamış HER2-pozitif (IHK3+) katı tümör hastaları için yeni bir umut ışığı sunuyor. Özellikle, bu onay ile HER2, tümör tipine bağlı olmaksızın (tümör agnostik), tedavi kararlarında belirleyici bir biyobelirteç haline geliyor. Bu, genomik test sonuçlarına dayanmayan, ancak lokalize HER2 testi ile (IHK ile 3+) pozitif olarak belirlenen hastalar için bir ilk olma özelliği taşıyor.






