BCG-yanıtsız Mesane Kanserinde Nogapendekin Alfa Inbakicept-pmln FDA Onayı Aldı
22 Nisan 2024 tarihinde, ABD Gıda ve İlaç İdaresi (FDA), Bacillus Calmette-Guérin (BCG) ile birlikte BCG-yanıtsız kasa-yayılmamış mesane kanseri olan yetişkin hastalar için nogapendekin alfa inbakicept-pmln (Anktiva, Altor BioScience, LLC) adlı ilacı onayladı. Bu kanser, yerinde karsinom (CIS, carcinoma in situ) ile birlikte veya papiller tümörlerle birlikte olabilir.
Nogapendekin Alfa Inbakicept-pmln Etki Mekanizması Nasıldır?
Nogapendekin alfa inbakicept-pmln (ticari adıyla Anktiva), bir biyolojik tedavidir. Bu ilaç, interleukin-2 (IL-2) adlı bir sitokin türevi olan alfa inbakicept ile genetik olarak değiştirilmiş bir formudur. Bu hali ile bir çeşit immünoterapidir. IL-2, bağışıklık sisteminin doğal bir parçasıdır ve T hücrelerinin aktivasyonunu ve çoğalmasını teşvik eder, böylece vücudun kendi savunma mekanizmalarını kullanarak kanser hücrelerine karşı savaşmasına yardımcı olur.
Nogapendekin alfa inbakicept-pmln, IL-2'nin bağışıklık sistemini harekete geçirme özelliklerini kullanır, ancak bu ilaç daha spesifik bir şekilde tasarlanmıştır, böylece doğrudan tümör mikroçevresine odaklanır ve orada bulunan bağışıklık hücrelerini aktive eder. Bu aktive edilmiş bağışıklık hücreleri, özellikle tümör hücrelerini hedef alır ve yok eder. İlacın, yerel olarak uygulanması (örneğin, mesane kanseri tedavisinde doğrudan mesaneye intravezikal / mesane içi yolla uygulanması gibi) doğrudan etkili olmasını ve sistemik yan etkileri azaltmasını sağlar.
Nogapendekin alfa inbakicept-pmln'in bu spesifik ve yerel uygulama şekli, özellikle BCG'ye (Bacillus Calmette-Guérin) yanıt vermeyen kasa yayılmamış mesane kanseri gibi durumlarda etkili bir alternatif tedavi yöntemi sunmaktadır. Bu özel tedavi yöntemi, kanser hücrelerine karşı bağışıklık tepkisini güçlendirmek ve tümörün büyümesini baskılamak için bağışıklık sisteminin doğal gücünden faydalanır.
FDA Onayı Getiren Çalışma
Etkinlik, BCG'ye yanıt vermeyen, yüksek riskli kasa-yayılmamış mesane kanseri olan 77 hasta üzerinde QUILT-3.032 (NCT0302285) isimli tek kollu, çok merkezli bir çalışmada değerlendirildi. Hastalar, BCG takiben nogapendekin alfa inbakicept-pmln indüksiyonu ve maksimum 37 ay süreyle devam eden idame tedavisi aldılar.
Tümör durumu, tedavi başlangıcından sonraki ilk 6 ay içinde zorunlu olarak yapılan biyopsi ve tedavi sonrası 2 yıl boyunca her 3 ayda bir sistoskopi ve idrar sitolojisi ile değerlendirildi.
Bulgular
- Tedaviye tam yanıt (CR: complete response) oranı %62 (95% CI: 51, 73) olarak bulundu.
- Tam yanıt elde edilen hastaların %58'inde tam yanıtın süresi (DOR) ≥ 12 ay, %40'ında ise DOR ≥ 24 ay olarak belirlendi.
Yan Etkiler
En yaygın yan etkiler arasında artmış kreatinin, disüri, hematüri, idrar sıklığı, idrar yapma aciliyeti, idrar yolu enfeksiyonu, artmış potasyum, kas-iskelet ağrısı, titreme ve ateş bulunmaktadır.
Doz Önerileri
Nogapendekin alfa inbakicept-pmln için önerilen doz, indüksiyon tedavisi olarak haftada bir kez BCG ile birlikte 6 hafta süreyle 400 mcg intravezikal olarak uygulanmasıdır. Eğer 3. ayda CR elde edilmezse, ikinci bir indüksiyon kursu verilebilir. İdame tedavisi için, önerilen doz aylar 4, 7, 10, 13 ve 19'da haftada bir kez BCG ile birlikte 3 hafta süreyle 400 mcg intravezikal olarak uygulanmasıdır.
Sonuç
BCG'ye yanıt vermeyen kasa-yayılmamış mesane kanseri hastaları için FDA'nın onayladığı nogapendekin alfa inbakicept-pmln, bu alanda umut verici bir tedavi seçeneği sunmaktadır. Tedavi planında bu yeni yöntemi kullanmayı düşünen sağlık uzmanlarının, tedaviye devam kararı için hastaları dikkatlice izlemesi gerekmektedir.
*
BCG-yanıtsız Kasa-yayılmamış Mesane Kanserinde FDA Onaylı Tedaviler
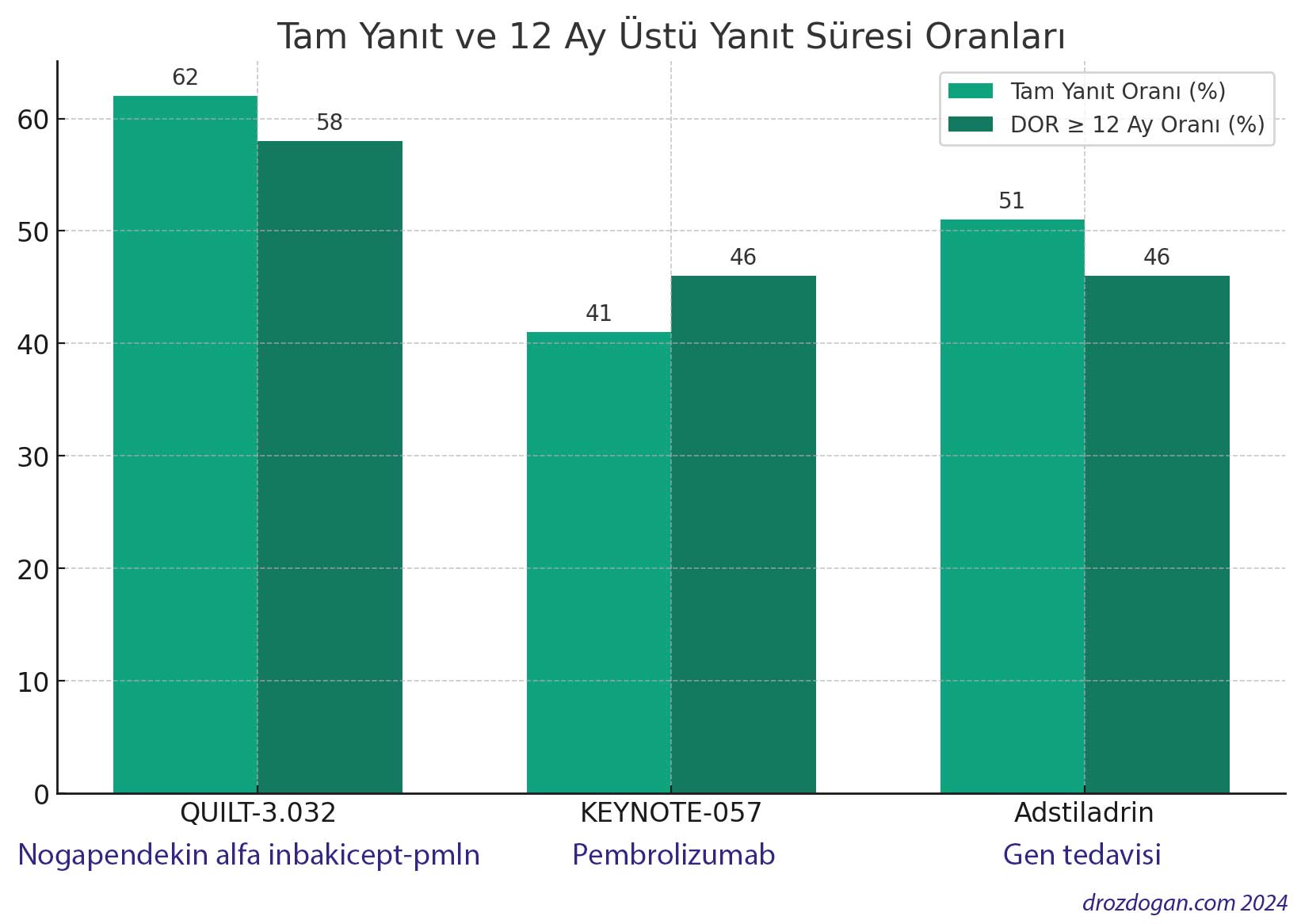
- QUILT-3.032 Çalışması: Nogapendekin alfa inbakicept-pmln ile tedavi edilen hastalarda, %62 oranında tam yanıt gözlemlenmiş ve bu yanıtın %58'i en az 12 ay, %40'ı ise en az 24 ay sürmüştür. Çalışmada ortanca DOR belirtilmemiştir.
- KEYNOTE-057 Çalışması: 2020'de FDA onayı aldı. Pembrolizumab immünoterapisi ile tedavi edilen hastaların %41'i tam yanıt vermiş, %46'sında ise yanıt en az 12 ay sürmüştür. Bu çalışmanın ortanca DOR'u 16.2 ay olarak kaydedilmiştir.
- Adstiladrin Çalışması: 2022'de FDA onayı aldı. Tedavi edilen hastaların %51'i tam yanıt elde etmiş, %46'sında bu yanıt en az 12 ay sürmüştür. Ortanca DOR bu çalışmada 9.7 ay olarak belirlenmiştir.
FDA approves nogapendekin alfa inbakicept-pmln for BCG-unresponsive non-muscle invasive bladder cancer. 04/22/2024
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-nogapendekin-alfa-inbakicept-pmln-bcg-unresponsive-non-muscle-invasive-bladder-cancer






