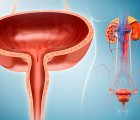
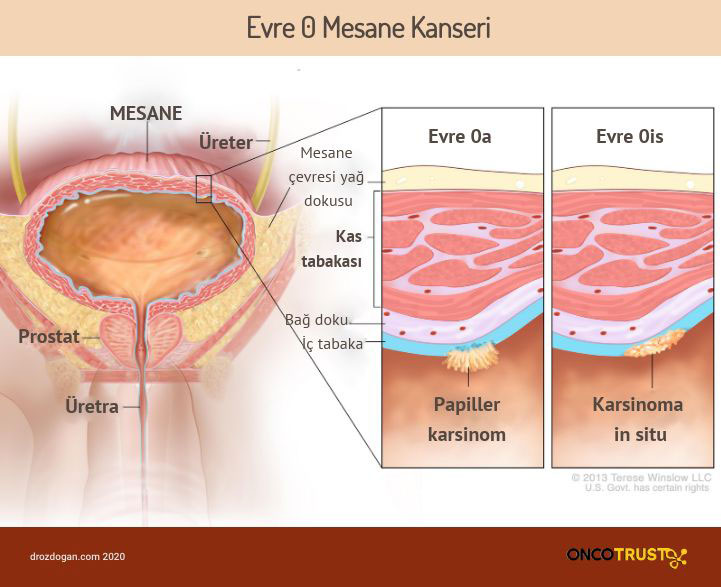
Yüksek riskli, BCG yanıtsız, kas tabakasına yayılmamış mesane kanserinde immünoterapi FDA onayı aldı
8 Ocak 2020'de, ABD Gıda ve İlaç İdaresi (FDA), pembrolizumab (Keytruda) adlı immünoterapiye, Bacillus Calmette-Guerin'ye (BCG) yanıt vermeyen, yüksek riskli, kas tabakasına yayılmamış, ameliyat için uygun olmayan veya olmamayı seçen, papiller tümörleri olan veya olmayan in situ karsinomlu (CIS) mesane kanserli hastalar için onay verdi.
Bu onay, immün kontrol noktası inhibitörü sınıfı yeni nesil immünoterapilerin, bir kanserin en erken evresinde aldığı ilk onay oldu ve kanser tedavileri için çok yönlü etkileri olacaktır.
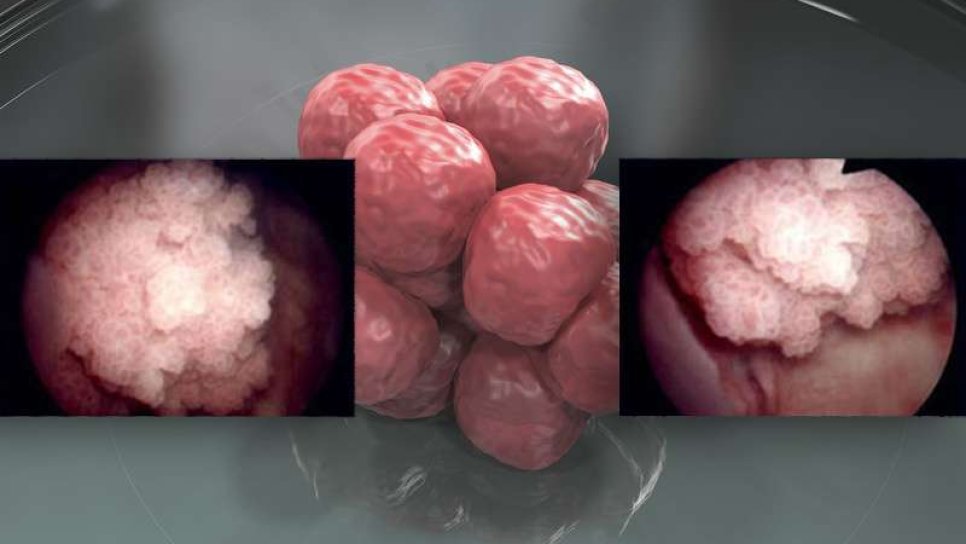
Çok merkezli, tek kollu bir klinik araştırma olan KEYNOTE-057, yüksek riskli kan tabakasına yayılmamış mesane kanserli 148 hastayı kaydetti; bu hastaların 96'sı BCG'ye yanıtsız papiller tümörü bulunan veya bulunmayan karsinoma in situ (CIS) tümörlere sahipti. Hastaların tamamı her 3 haftada bir 200 mg pembrolizumab immünoterapisini aldı, ta ki kabul edilemez yan etki, dirençli, tekrarlayıcı veya ilerleyici hastalık gelişmemiş ise 24 aya kadar.
Başlıca etkinlik sonuç ölçümleri tam yanıt ve yanıtın süresi olarak belirlendi. Tam yanıt, sistoskopide (mesanenin ucunda küçük bir kamera bulunan ince bir tüp ile görüntülenmesi ve örnek alınması), idrar sitolojisi (hücre analizi) ve bilgisayarlı tomografi görüntüleme ile belirlendi.
Sonuç olarak, önceki BCG tedavisine yanıt vermeyen 96 hastanın %41'i pembrolizumab immünoterapisine tam yanıt verdi ve ortanca yanıt süresi 16.2 ay idi. Yanıt veren hastaların % 46'sında, en az 12 ay süren tam bir yanıt görüldü.
KEYNOTE-057'de pembrolizumab alan hastalarda en sık (≥% 10) görülen yan etkiler yorgunluk, ishal, döküntü, kaşıntı, kas-iskelet ağrısı, hematüri, öksürük, artralji (eklem ağrısı), bulantı, kabızlık, idrar yolu enfeksiyonu, periferik ödem (el ve ayakta şişlik), hipotiroidizm (tiroid hormonlarının azlığı) ve nazofarenjittir (üst solunum yolu enfeksiyonu). Önerilen pembrolizumab dozu 3 haftada bir 200 mg'dır.
FDA approves pembrolizumab for BCG-unresponsive, high-risk non-muscle invasive bladder cancer.
fda.gov - 8 January 2020.