
İmmunoterapi ve Kanser Aşısı
İmmünoterapi Nedir?
İmmünoterapi, vücudun kanser, enfeksiyon ve diğer hastalıklarla savaşmasına yardımcı olmak için bağışıklık sistemini uyaran veya bazen de baskılayan biyolojik ajanların kullanıldığı bir tedavi türüdür.
Bazı immünoterapi türleri, yalnızca bağışıklık sisteminin belirli hücrelerini hedef alır. Diğerleri bağışıklık sistemini genel bir şekilde etkiler. İmmünoterapi türleri arasında sitokinler, aşılar, Basil Calmette-Guerin (BCG) ve bazı monoklonal antikorlar bulunur.
Kanser İmmünoterapisi Nedir?
Kanser immünoterapisi, bağışıklık sistemini kanserle savaşmak üzere tetikleyen tedavilerdir.
Bağışıklık (immün) sistemi eforunun önemli bir kısmını normal hücreler ile yabancı hücreleri ayırmak için harcar. Bunu gerçekleştirmek için, hücresel düzeyde "kontrol noktalarını" kullanır. Savunma sistemini aktifleştirmek için, kontrol noktalarına etki eden moleküllerin aktif veya pasif konumda olması gerekir. İşte 2011 sorası kanser tedavisinde çığır açan ve savunma sistemini aktifleştiren ilaçlara immün kontrol noktası düzenleyicileri denir. İmmün kontrol noktalarının keşfi, 2018 Nobel Fizyoloji veya Tıp Ödülü'ne layık görüşmüştür.
İmmünoterapi, cerrahi, radyoterapi ve kemoterapiden sonra kanser tedavisinin 4. ayağı olarak adlandırılmaktadır.
Kanser İmmünoterapisi – Özet Video Anlatım
İmmünoterapi Akıllı İlaç mı?
Akıllı kanser ilaçları, belirli genetik değişimleri, örneğin kanserle ilişkili mutasyonları hedef alacak şekilde tasarlanmış, çoğu küçük molekül yapısındaki ilaçlardır. Bu nedenle immünoterapiler ve akıllı ilaçlar birbirinden farklıdır.İmmünoterapilerin amacı bağışıklık sistemini kansere karşı aktifleştirmek varken, akıllı ilaçlar kanseri tetikleyen genetik değişimleri baskılamayı amaçlar.
İmmünoterapi Hangi Kanserlerde Kullanılır?
İlk olarak 2011 yılında kanser tedavisi olarak kullanılmaya başlanan “immün kontrol noktası baskılayıcı” sınıfından immünoterapiler, aşağıda sıralanan kanser endikasyonunda FDA (ABD Gıda ve İlaç İdaresi) onayı almış ve kanser tedavi rehberlerine girmiştir.
NOT: Önemli bir gelişme olarak 8 Şubat 2022'de Opdivo (nivolumab), ileri evre küçük hücreli dışı akciğer kanserinin ikinci basamak tedavisi olarak SGK (Sosyal Güvenlik Kurumu) tarafından geri ödeme kapsamına alındı. Böylelikle ülkemizde, akciğer kanseri için ilk kez ve tek olarak bir immünoterapi ilacı, bedeli kurum tarafından karşılanacak şekilde hastaların kullanımına sunuldu.
Kanser tedavisinde FDA onaylı "immün kontrol noktası inhibitörü" sınıfından immünoterapiler şunlardır:
Kanser tedavisi için FDA onaylı diğer immünoterapi çeşitleri şunlardır:
- Talimogene Laherparepvec (Imlygic): melanom için gen tedavisi şeklinde hazırlanmış bir çeşit immünoterapi (detaylar aşağıda).
- Sipuleucel-T (Provenge): prostat kanseri için kişiye özel dentritik hücre kanser aşısı. Sadece ABD'de bulunuyor (detaylar aşağıda).
- CAR T-hücre canlı kanser ilaçları: hematolojik (kan ve kemik iliği kaynaklı) kanserlerin tedavisinde ABD ve Avrupa'da kullanılıyor. Adoptif hücresel tedaviler olarak da adlandırılmakatdır, detaylı bilgi için bakınız.
İmmünoterapinin Yan Etkileri Nelerdir?
İmmünoterapilerin yan etkisi olmadığı doğru değildir. Bu ilaçlar, kemoterapilere kıyasla daha az yan etkilere neden olmakla birlikte, bağışıklık sisteminin aşırı aktifleşmesine bağlı - çoğunluğu hafif şiddetli olsa da - ciddi yan etkilere neden olabilirler (bakınız immünoterapi yan etkileri).
İmmünoterapi yan etkilerinin genel özellikleri şu şekildedir:
- İmmünoterapi yan etkileri, kansere karşı harekete geçen bağışıklık sisteminin vücudun normal kısımlarına da zarar vermesi ile oluşur.
- Genel olarak anti-CTLA-4 monoklonal antikor türü immünoterapilerin (örneğin ipilimumab etken maddeli Yervoy) yan etkilerinin sıklığı ve şiddetli, anti-PD-1 veya anti-PD-L1 immünoterapilere göre (örneğin Opdivo, Keytruda, Imfinzi, Tecentriq ve Bavencio) daha fazladır.
- Kombinasyon immünoterapilerinde, tek ajan (monoterapi) immünoterapilere göre daha sık ve şiddetli yan etkiler gözükür.
- İmmünoterapi yan etkileri hemen hemen tüm organ sistemlerini etkileyebilir. En sık olarak deri, bağırsak, endokrin (hormonal sistem) ve akciğerler; daha nadir olarak kalp-damar sistemi, kemik iliği, böbrek, sinir sistemi ve göz.
- İmmünoterapilerle tedavi sırasında genellikle hafif (1. ve 2. derece) yan etkiler gözükür, fakat kemoterapilerden farklı olarak bu yan etkiler bazen aylarca sürebilir.
- En sık görülen immünoterapi yan etkileri ağız yaraları (mukozit), ishal, cilt alerjileri ve grip benzeri şikayetlerdir (yorgunluk, ateş, titreme, halsizlik, bulantı, kusma ve döküntü gibi).
İmmünoterapi Tedavisi Ne Kadar Sürer?
Kanserde yaygın olarak "immün kontrol noktası inhibitörü" sınıfından immünoterapiler kullanılır. Bunlar monoklonal antikor yapısındandır ve damardan serum şeklinde uygulanır. Her bir kürde uygulama süresi 30-60 dk arasındadır. İmmünoterapiler, kullanılan ilaca böre değişmekle birlikte 14 ya da 21 günde bir uygulanır. Toplam immünoterapi tedavi süresi, hasta tedaviye yanıt vermeye devam ettiği sürecedir; genel olarak immünoterapiler 2 yıla kadar uygulanır. Tolere edilemeyecek düzeyde yan etki gelişmesi veya kanserde progresyon (ilerleme) olması durumunda ise tedavi kesilir.
Son yıllarda bazı immünoterapilerin 4 haftada bir (Opdivo için) ve 6 haftada bir (Keytruda için) dozları da FDA onayı almıştır.
Doğal İmmünoterapi Yöntemi Var mı?
Günümüzde etkili olduğu kanıtlanan immünoterapi yöntemleri laboratuvarda üretilen monoklonal antikor yapısındaki veya genetik olarak tasarlanmış biyoteknoloji ürünü ilaçlardır. Bunların dışında doğada hazır bulunan herhangi bir bitkisel ürünün (fitoterapinin) immünoterapi etkisi kanıtlanmamıştır. İlaçlar dışında bağışıklık sistemini destekleyecek iki yaklaşım bulunmaktadır: bunlar egzersiz ve sağlıklı beslenmedir.
İlginizi Çekebilir: Egzersiz, bir kanser ilacıdır!
Türkiye'de İmmünoterapi Yapan Hastaneler Hangileridir?
Türkiye'de tıbbi onkolog bulunan ve aktif kemoterapi merkezi bulunan tüm hastanelerde immünoterapi yapılmaktadır. Bununla birlikte immünoterapiler her kanserde ve her durumda uygulanmaz. Ayrıca ülkemizde immünoterapiler sadece az sayıda kanserde SGK (Sosyal Güvenlik Kurumu) tarafından geri ödeme kapsamındadır.
Ülkemzide bir ilaç için T.C. Sağlık Bakanlığı'ndan onaylı / ruhsatı olması ile T.C. Alie, Çalışma ve Sosyal Hizmetler Bakanlığı'na bağlı olan Sosyal Güvenlik Kurumu (SGK) tarafından geri ödeme kapsamında olması aynı şey değildir. Bir ilaç, belli bir hastalık için Sağlık Bakanlığı tarafından onaylandığı halde SGK tarafından henüz geri ödeme kapsamına alınmamış olabilir. Yeni nesil kanser ilaçlarından olan immünoterapilerde bu durumla sık karşılaşmaktayız.
Ülkemizde, yeni nesil immünoterapiler olan immün kontrol noktası inhibitörleri, ancak şu 4 kanser için SGK tarafından geri ödeme kapsamındadır:
- Malign melanom tedavisi
- Klasik Hodgkin lenfoma tedavisi
- Böbrek kanseri tedavisi
- Akciğer kanseri tedavisi
Bununla birlikte immün kontrol noktası inhibitörleri şu durumlar için Sağlık Bakanlığı tarafından ruhsatlandırılmıştır:
- Melanom adjuvan tedavisi
- İleri evre melanom tedavisi
- İleri evre böbrek kanseri tedavisi
- Klasik Hodgkin lenfoma tedavisi
- İleri evre küçük hücreli dışı akciğer kanseri tedavisi
- Evre IIIB küçük hücreli dışı akciğer kanseri idame tedavisi
- İleri evre küçük hücreli akciğer kanseri tedavisi
- İleri evre yassı hücreli baş-boyun kanseri tedavisi
- Mikrosatellit instabilitesi yüksek (MSI-H) veya uyumsuzluk onarım eksikliği (dMMR) olan metastatik kolorektal kanser tedavisi
- Metastatik Merkel hücreli karsinomlu (MHK) erişkin hastaların tedavisi
- Rezeke edilemeyen lokal ileri veya metastatik evre 1. basamak platin bazlı kemoterapiyi takiben hastalığı progresyon göstermemiş PD-L1 pozitif ürotelyal karsinomu (ÜK) olan yetişkin hastaların idame tedavisinde monoterapi olarak (avelumab etken maddeli Bavencio)
Şimdiye kadar, kanserde immünoterapi konusunda en çok merak edilenleri kısaca soru-cevap şeklinde özetledik. Yazımızın devamında kanser immünoterapi çeşitleri hakkında detaylı bilgiye yer veriyoruz.
*
Kanser İmmünoterapisine Giriş – Detaylı Anlatım
Bu immün kontrol noktaları terimi birçok yerde farklı kullanılmaktadır:
- bağışıklık sistemi kontrol noktası baskılayıcıları / düzenleyicileri
- immün checkpoint inhibitörleri
- kanser immünoterapisi
Yazımızın devamında da göreceğimiz üzere kanser immünoterapisi en az 8 başlıkta incelenmektedir, fakat günümüzde kanser immünoterpisi denilince akla ilk olarak immün kontrol noktası düzenleyicileri gelir. Bu immünoterapi ilaçları PD-1, PD-L1 ve CTLA4 adlı hücre yüzey moleküllerininin çalışmasını engelleyerek bağışıklık sistemi hücrelerinin aktifleştirir.
Kanserde immünoterapinin amacı, bağışıklık sistemini kanserle savaşmak üzere tetiklemek, güçlendirilmek ve yeniden düzenlemektir.
İmmünoterapi ilaçları oldukça yeni olmalarına karşılık, bağışıklık sistemini aktifleştirerek kanseri tedavi etme fikri oldukça eskilere dayanmaktadır, ve aslında cerrahi-olmayan ilk kanser tedavisidir; kemoterapi ve radyoterapiden daha önce keşfedilmiştir.
Neredeyse 100 yıla yakın zamandır kanser tedavi alanında yürütülen çalışmalarda, kanser hücresine yönelik doğrudan öldürücü yöntemler hedeflendi. Oysa vücudun kendini koruyan en önemi mekanizmalarından birisi olan immün sistemin (bağışıklık sistemi) gücü anlaşılamadı veya immün sistemin yetersizliği kanser hücresinin gücüne atfedildi.
Vücudumuzda yer alan immün sistemimiz iki ucu keskin bıçak gibidir. Aşırı ve kontrolsüz çalışmasında immün aşırılık olarak tanımlayabileceğimiz çeşitli organların hasarı ile giden hastalıklar ortaya çıkar. Yetersiz çalışmasında ise infeksiyonlar başta olmak üzere kansere yatkınlığa varan olumsuz durumlar ortaya çıkar.
Kanser İmmünoterapisinin Kısa Tarihi

Bundan 126 yıl önce New Yorklu bir cerrah olan William Coley, ileri evre kansere sahip bir hastanın ateşli bir infeksiyon sonrası kanserinin gerilediğini gözlemler. Bunun üzerine bakteriyel infeksiyonun bir şekilde tümör küçülmesinden sorumlu olduğunu düşünmeye başlar ve başka bir hastaya canlı bakteriler enjekte eder. Bu deneyi işe yarar, ve hasta başka bir sebepten yaşamını yitirene kadar 26 yıl yaşar. Coley bir şeyler yakaladığını düşünür. Araştırmaya ve bakterinin kullanımı üzerinde çalışmaya devam eder. Coley ve bu alanda çalışan diğer doktorlar bu yöntemle 1000’den fazla sayıda hastayı tedavi ettiklerini raporlamışlardır. Ateşli infeksiyon oluşturarak kanseri tedavi etmede kullanılan Coley toksinleri, karma bakteriyel kanser aşısı olarak da adlandırılmaktadır. Coley ilk denemesinde başarılı olmuştu, fakat sonraki denemeleri her zaman yüz güldürücü sonuçlanmadı.
Hiç kimse Coley toksinlerinin, yani ateşli infeksiyonların nasıl işe yaradığını veya neden bazen işe yarayıp, bazense işe yaramadığını bilmiyordu. Coley bile bunu izah edemiyordu. Sonraları daha iyi anlaşılacaktı ki Coley toksinleri, vücutta ateşli bir infeksiyon oluşturarak bağışıklık sistemini aktive eden ve düzenleyen çeşitli mekanizmaları tetikliyordu. Tıpkı günümüzdeki immünoterapilere benzer şekilde, fakat farklı mekanizmalarla.
100 yıl sonra kaldığı yerden...
1900’lerin başında radyoterapi daha sonra da kemoterapi geliştirildiğinde, Coley’in toksinlerine olan ilgi bu yeni tedavilerin gölgesinde kaldı. Ta ki 1990’larda kanserle baş etmede immün sistem aracılı ilaç geliştirme konusunda umutlarını yitirmeyen Prof. James Allison’a kadar. Allison’un CTLA-4 adı verilen özel bir biyolojik molekül ilgisini çekti. Allison ve arkadaşları yaptıkları çalışmada T hücreleri olarak adlandırılan, bağışıklık sisteminin en önemli hücrelerinin üzerinde olan bu molekülün, T hücrelerinin aktivitesini frenleyerek (inhibe ederek) bağışıklık sistemini kansere karşı susturduğu kanıtladı. T hücrelerinin bağışıklık sisteminin saldırı düzenlemesinde kritik rolü olduğu biliniyordu. Bu engellemenin kaldırılmasının kanser tedavisinde işe yarayıp yaramayacağı merak edildi ve kanserli fare modellerinde denenmeye başlandı. 1996 yılında yayımlanan bir yazılarında Jim Allison, Max Krummel ve Dana Leach, CTLA-4’ün aktivasyonunun bir antikor aracılığı ile engellendiği farelerde tümör büyümesinin ortadan kaldırabilir olduğunu gösterdiler.
İmmün kontrol noktası düzenleyicileri (checkpoint regulators) olarak tanınan ve kanser tedavisinde çığır açan ilaçlara bu çalışma ilham kaynağı oldu. Bu gelişmeden sonra CTLA-4 engelleyici bir antikor olan İpilimumab (piyasa adı Yervoy), malign melanom isimli, son derece agressif seyirli bir cilt kanseri türünün ileri (4.) evresine sahip hastalarda etkin bulundu ve binlerce kişinin yaşamını kurtardı.
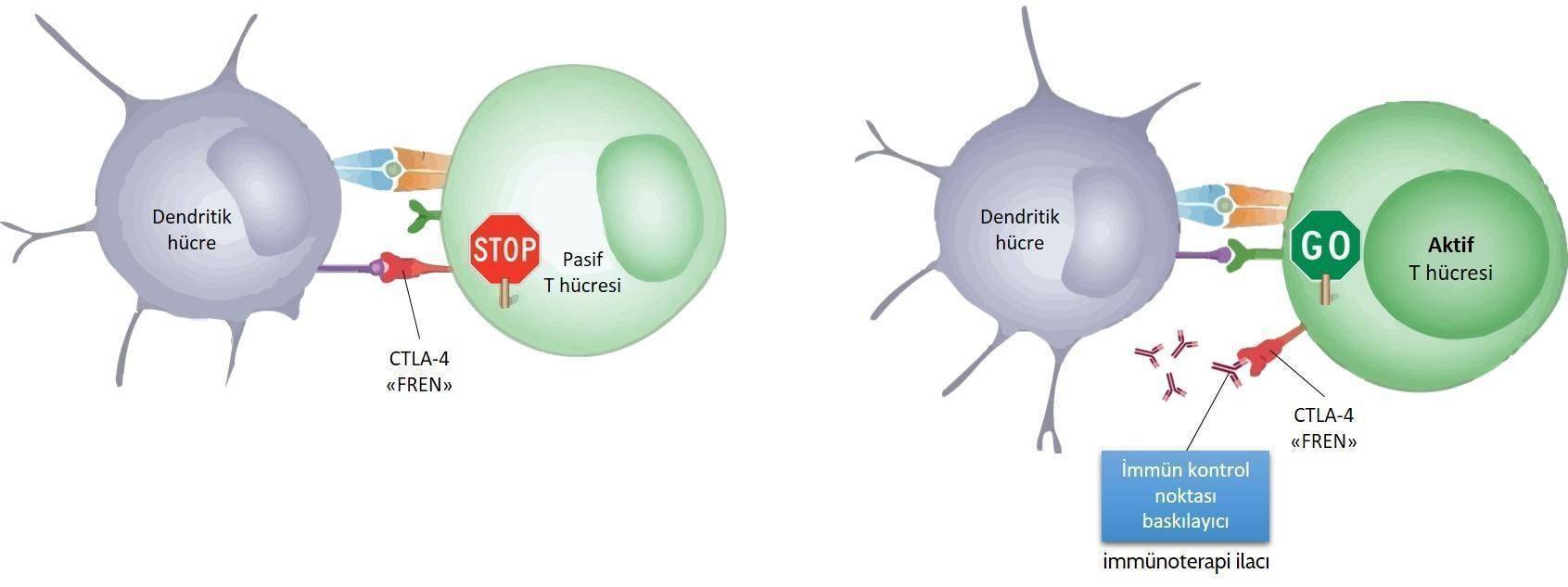
Bu önemli gelişmeden sonra bağışıklık sistemini kontrol noktaları üzerinden aktifleştirecek başka yollar aranmaya ve bulunan moleküller birçok kanser türünde denenme başlandı. 2000'li yılların başında yapılan çalışmalar kanserin, bağışıklık sisteminden kaçmak için CTLA-4 dışında PD-1 ve PD-L1 adlı hücre yüzey moleküllerini de kullandığını ortaya koydu.
PD-1 sadece bağışıklık sistemi hücrelerinin yüzeyinde bulunur ve kendi uyarıcı moleküllerine (ligand) bağlandığında bağışıklık hücreleri, dolayısı ile bağışıklık sistemi pasifleşir. PD-1'in kendi uyarıcı moleküllerine bağlanmasını engelleyen ve şu an kullanımda olan 3 immünoterapi ilacı vardır: nivolumab (piyasa adı Opdivo), pembrolizumab (Keytruda) ve cemiplimab (Libtayo).
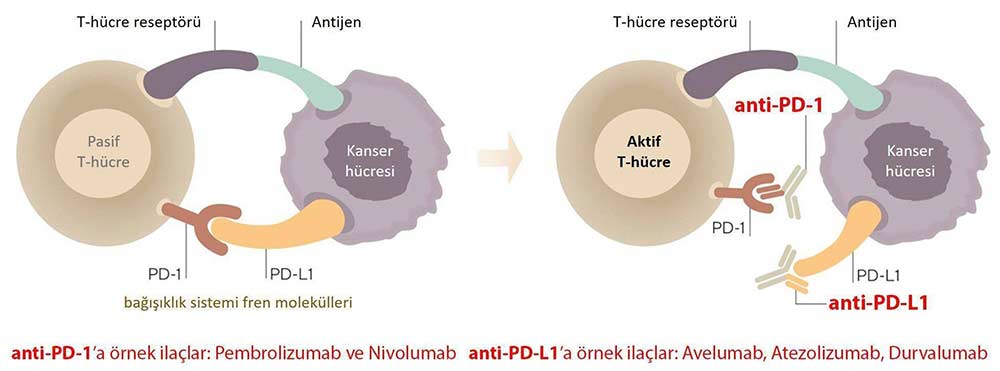
PD-L1 hem bazı bağışıklık sistemi hücreleri, hem kanser hücrelerinin yüzeyinde bulunan protein yapıda bir uyarıcı moleküldür ve PD-1 reseptörüne bağlandığında, bağışıklık sistemi hücresini pasifleştirir. PD-L1'i hücre yüzeylerinde yoğun bir şekilde barındıran tümörlerin, ki bunlara PD-L1 pozitif tümörler denir, daha agresif yapıda olduğu, buna karşın immünoterapi ilaçlarının bu kanserlerde daha etkin olduğu bulunmuştur. PD-L1'in PD-1'e bağlanmasını engelleyen ve şu an için FDA onayı alan ilaçlar atezolizumab (Tecentriq), avelumab (Bevancio) ve durvalumabtır (Imfizni).
Kanserde İmmünoterapi Çeşitleri Nelerdir?
Günümüzde "kanser immünoterapisi" denilince akla ilk olarak, yukarıda uzunca bahsettiğimiz "immün kontrol noktası inhibitörü" ilaçlar gelmekle birlikte, kanserde kullanılan immünoterapiler tek çeşit değildir. Aşağıda detayı inceleyeceğimiz "kanser aşıları" ve "CAR-T" gibi canlı ilaçlar da immünoterapi başlığında değerlendirilmektedir. Gelin şimdi kanser tıbbının en hareketli alanı olan kanser immünoterapilerinin çeşitlerini birlikte inceleyelim:
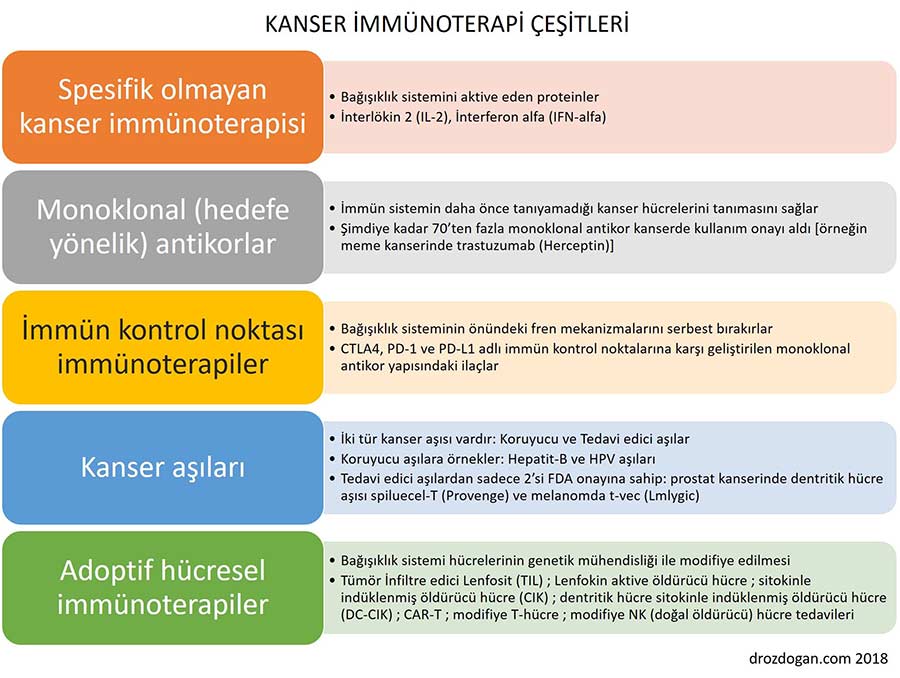
İlginizi Çekebilir: Kanser Tedavisinde Canlı İlaçlar
1. Hastalığa özgü olmayan immün aktivatörler
İlk modern immünoterapiler Coley toksinlerinden esinlenmiştir ve patojenlerin ve kanserlerin tüm çeşitlerine karşı bağışıklık sistemi yanıtını artırmayı amaçlamışlardır. Bu tür uygulamalar sonucu tedavi edilmek istenen hastalığa özgü olmayan (non-spesifik) bir bağışıklık sistemi yanıtı elde edilmiştir. Bu non-spesifik immünoterapiler hala bazı kanser türlerinin tedavisinde bizlere yardımcı olmaktadır.
BCG aşısı
İlk modern immünoterapi ilacı tüberküloza (verem) neden olan bakterinin zayıflatılmış hali olan BCG’dir (Bacillus Calmette-Guerin). 20. yüzyıl boyunca BCG, verem hastalığına karşı bir aşı olarak kullanılmıştır. 1950’lerin sonunda BCG kanserde denenmeye başlandı. Birçok kanserde ve onlarca yıl denenmesine karşı, 1990’a gelindiğinde sadece erken evre tekrarlama riski yüksek mesane kanserinde kullanım onayı almıştır ve halen bu kanserin ana tedavilerden biridir.
Sitokinler
Sitokinler, bağışıklık sistemi hücrelerinin birbirleri ile iletişimde kullandıkları moleküllerdir. Hastalığa özgül olmayan (non-spesifik) immünoterapi ilaçları olarak kullanılmaktadırlar.
Birçok yolla tümörün bağışıklık sistemi tarafından tanınmasında rol alırlar. En bilinenleri Tümör Nekroz Faktör Alfa (TNFα) ve İnterferon alfa (IFNα), hücrelerin intihar etmesini ve büyümelerinin durmasını sağlayarak, direkt olarak kanser hücrelerine etki eder. İnterLökin-2 (IL-2) ve GM-CSF, immün sistemin doğal öldürücü hücrelerini (natural killer = NK), T hücrelerini ve dentritik hücreleri aktive ederler.
Bu moleküllerden IL-2, malign melanom ve böbrek kanserinde kullanılmaktadır. INFα melanom, kronik myelositik lösemi, hair cell lösemi, foliküler Hodgkin-dışı lenfoma, ve Kaposi sarkomunda kullanılmaktadır.
Adjuvanlar
Ajuvanlar da non-spesifik immün tetikleyicilerdir ve sıklıkla daha güçlü bir bağışıklık yanıt oluşturmak için çoğunlukla aşılarla birlikte uygulanır.
Sıklıkla kullanılan adjuvan moleküller bakteri ürünleri ve TLR (Toll-like receptor) agonistleridir. Ayrıca bağışıklık sisteminin önemli elemanlarından dentritik hücreleri uyaran GM-CSF, kanser aşısı adjuvanı olarak sıklıkla kullanılmaktadır.
2. Antikor İmmünoterapiler
Şimdiye kadar adı geçen immünoterapiler belli bir antijeni (özgül protein molekülü) hedef almadan, bağışıklık hücrelerini genel olarak uyarırlar. Bu bölümdeki immünoterapiler ise belli bir antijeni hedef aldıkları için “spesifik immünoterapiler” olarak adlandırımaktadır.
Monoklonal antikorlar
Antikorlar, immün sistem tarafından üretilen ve görevleri bizleri patojenlerden ve kanser hücrelerinden korumak olan proteinlerdir. 1970’lerden beri laboratuvar ortamında da üretilebilen yüksek seçicilikteki bu saflaştırılmış moleküllere monoklonal antikorlar denilmektedir.
Monoklonal antikorların tedavi alanında birçok kullanımları mevcuttur.
- Kanser hücrelerinin büyüme ve çoğalmak için kullandıkları sinyal moleküllerini bağlayabilirler;
- Kanser hücrelerine bağlanarak onların bağışıklık hücreleri tarafından tanınıp yok edilmesine aracı olabilirler;
- Tümör hücrelerinin patlamasına neden olan komplemanları aktive edebilirler.
Kanser tedavisi için şimdiye kadar yaklaşık 20 monoklonal antikor FDA onayı almıştır. En yaygın olarak kullanılanlar trastuzumab (meme ve mide kanserleri), bevasizumab (başta kalın bağırsak, beyin, yumurtalık, serviks ve akciğer olmak üzere birçok kanser) ve rituksimabdır (bazı lenfoma ve lösemilerde).

Herceptin (etken madde ismi trastuzumab) kanser alanında ilk kullanılan monokonal antikorlardan biridir ve meme kanserinin adeta tarihini değiştirmiştir. Meme kanserlerinin %25-30 kadarı hücre yüzeylerinde HER2 reseptörünü normalden fazla miktarda bulundurur ki bu reseptör hücrenin büyüme ve çoğalmasını kontrol etmektedir. Herceptin bu önemli büyüme reseptörünün aktivitesini engeller ve hücreyi ölüme götürür.
Monokonal antikorlar çok özgül hedeflere bağlandıkları için oldukça az yan etkiye sahiptirler. Bununla birlikte etkilerine zamanla direnç gelişebilir.
Bisipesifik antikorlar
Antikor terapilerinin yeni bir formu olan bispesifik antikorlar, genetik mühendisliği ile iki farklı hedefe kilitlenen moleküllerdir. Fiziksel olarak iki farklı monoklonal antikorun birbiri ile bağlanarak oluşturulan proteinlerdir.
Bispesifik antikorların en yaygın formu, bir yandan T-hücreye, diğer yandan kanser hücresine bağlanabilen bispesifik T-cell engagers (BiTEs) adıyla anılan genetik mühendisliği ürünleridir.
FDA onayı alan BiTE örneği B-hücreli lösemi tedavisinde kullanılan blinatumomab adlı ilaçtır. Bu ilaç bir yandan T hücresi üzerindeki CD3’e, diğer yandan tümör hücresi üzerindeki CD19 adlı moleküllere bağlanır.
3. Kanser Aşıları
Kansere bağlı yaşam kayıplarının temel nedeni kanser hücrelerinin başka doku ve organları “işgal” etmesidir. Bu duruma metastaz adı verilir. Son yapılan araştırmalara göre metastazın kanserden ölümlerin yüzde 90’ından sorumlu olduğu belirtilmiştir. Metastaz yapmış, yani dördüncü evre kanserlerde kullanılan tedavilerin başarısının arzu edilen düzeyde olmaması ve bir takım yan etkilere sebep olması araştırmacıları yeni kanser tedavileri geliştirmeye yöneltmiştir. Son yıllarda kanser aşıları büyük popülerlik kazanmış ve birçok ilaç firması bu konuda araştırmalarını yoğunlaştırmıştır. Bu bağlamda kanser aşılarını iki grupta toplayabiliriz:
Bunlar;
- Koruyucu (profilaktik)
- Tedavi edici (terapötik) kanser aşılarıdır.
Koruyucu (profilaktik) kanser aşıları
Virüslerin kansere neden olduğu 1900’lerin başından beri biliniyor. Dünya Sağlık Örgütü’nün yayınladığı son raporlara göre dünyadaki kanserlerin yüzde 15’i virüs kaynaklıdır. Virüs kaynaklı kanserlerin çoğu az gelişmiş ve gelişmekte olan ülkelerde görülmektedir. Bunun nedeni aşılama programlarının düzenli yapılmaması ve gerekli hijyen koşullarının yerine getirilmemesidir. Bu virüsler için kullanılan genel terim onkovirüs şeklindedir.
Onkovirüsler hücreleri enfekte ederek yani onların içine girerek hücrenin kontrolünü ele geçirirler. Bunu kendilerini çoğaltmak için kullanılırlar. Bilindiği üzere hücrelerimizde temel olayları kontrol eden DNA molekülü vardır. Virüsler kendi genetik bilgilerini girdikleri hücrelerin DNA’sına katarlar. Gen yapısı bozulan hücreler kontrolsüz bölünmeye ve çoğalmaya başlar. Sonuç olarak kanserleşme meydana gelir. İleride detaylı olarak inceleyeceğimiz gibi bazı virüsler tümör baskılayıcı genlerin aktivitesini engeller, bazıları ise hücreye onkogenler (hücre büyümesini tetikleyen genler) ilave eder. Şu ana kadar kansere neden olduğu tespit edilen virüsler ve kanser tipleri aşağıda listelenmiştir.
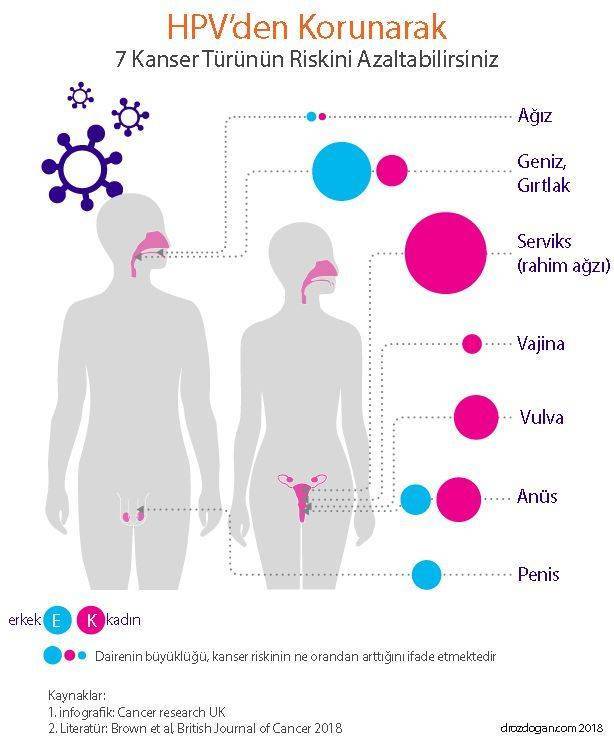
- Hepatit B ve C Virüsleri: Karaciğer kanseri
- Human Papilloma Virüs (HPV): Rahim ağzı ve rahim kanseri
- Human T-lymhotrophic Virus: Yetişkinlerde görülen T-Hücre lenfoma
- Epstein Barr Virus: Burkitt’s lenfoma, Hodgking lenfoma, gırltak kanserleri
- Kaposis Sarkomu Virusü: Kas kanserleri
Önemle vurgulamak gerekir ki, bu virüslerin kansere neden olma yüzdeleri çok düşüktür. Yani bu virüslerle enfekte olmuş bir insanın hayatı boyunca kansere yakalanmadığı da araştırmalarda görülmüştür.
Son yıllarda en çok araştırılan ve aşı geliştirilen virüs tipleri Hepatit virüsleri ve Human Papilloma Virüs’tür (HPV). Hepatit virüsleri kronik hepatit enfeksiyonuna neden olarak karaciğer kanserine neden olurlar. Her yıl 750.000 karaciğer kanseri rapor edilmekte ve bu vakaların çoğunluğu az gelişmiş ülkelerde görülmektedir. Hepatit B virüsü dünya nüfusunun yüzde 3’ ünü enfekte etmiş durumdadır ve aşılama programlarının yapılamadığı az gelişmiş ülkelerde karaciğer kanseri vakalarının yüzde 90‘ından sorumludur.
İlgili konu: HPV (Human Papilloma Virüs) Nedir? Nasıl Kansere Yol Açar?
Human Papilloma Virus (HPV), rahim ağzı (serviks) kanserine sebep olduğu kanıtlanmış bir virüstür. Hatta yapılan son çalışmalarda gösterilmiştir ki serviks kanserlerinin %99’una etken HPV’dir. Virüs daha çok genital bölgeyi etkiler ve çoğunlukla cinsel yolla bulaşır. Bu virüsler genital bölgede siğillerin oluşmasına ya da anormal hücre büyümelerine sebep olur. Genital siğiller cinsel ilişki yoluyla yayılan en önemli enfeksiyonlardan biridir. Genital siğillerin tedavisi cerrahi müdahale ve ilaçlarla mümkün olmakla birlikte bireylerin çoğunda nüksettiği görülmüştür. Bütün bunların yanında HPV nasıl kanserleşmeye neden olur? Bu sorunun cevabı genlerimizin kontrolden çıkmasıdır. Gelin bu mekanizmayı hep birlikte inceleyelim;
Hücrelerin bölünme hızı yaşamın ilk anından itibaren çok hızlıdır ve bu yetişkinliğe kadar devam eder. Yetişkin bir insanda hücreler ancak yaralanan dokuların onarımı için bölünür ve çoğalırlar. Bu olay her hücre tipinde görülmez. Örneğin sinir ve kas hücrelerimiz kendilerini yenileyemezler. Hücrelerde bölünme mekanizmasını kontrol eden en önemli gen p53’tür. Bu gen bilim adamları tarafından “genlerin bekçisi” olarak isimlendirilmiştir. p53 tümör baskılayıcı bir gendir. Hücrenin genetik yapısı hasar gördüğünde hücre bölünmesini durdurarak bu hasarlı genlerin yeni hücrelere geçmesini engeller ve hasarlı bölgeyi tamir edecek mekanizmaları başlatır. Eğer bunda başarılı olamazsa programlı hücre ölümünü başlatarak hasarlı hücrenin ortadan kalkmasını sağlar. Bu yüzden p53 geni hücreler için büyük önem taşır. p53 mutasyona uğradığı takdirde hücre kontrolsüz büyümeye başlar. İnsandaki kanserlerin % 50’sinde p53 geni mutasyona uğramış halde yani inaktif olarak bulunmuştur. Peki, HPV ile p53 geni arasında nasıl bir ilişki vardır? HPV hücreyi enfekte ederek kendi genlerini hücreye entegre eder. Bunun sonucunda oluşan E6/E7 adı verilen virüs proteinleri p53 genini fonksiyonsuz hale getirir. Hücredeki kontrol sisteminin ortadan kalkması kontrolsüz bölünmeye neden olur.
HPV’ye karşı 2006 yılında Amerikan Gıda ve İlaç Dairesi (FDA) onayı alınarak piyasaya sunulan Gardasil ve Cervarix adlı aşılar ile bağışıklık sağlanabilmektedir. Gardasil ergenlik öncesi ve aktif cinsel yaşama başlamış bireylere önerilmektir. Unutulmamalıdır ki enfekte olmuş bir birey için bu aşıların koruyucu etkisi yoktur. Gardasil 120’den fazla ülkede onaylanmış bir aşıdır. Rahim ağzı kanseri aşıları ülkemizde de satışa sunulmuştur Yapılan son araştırmalarda aşılama programını uygulayan ülkelerde rahim ağzı kanseri görülme oranının azaldığı rapor edilmiştir.
Terapötik (tedavi edici) kanser aşıları
Tedavi amaçlı geliştirilen kanser aşıları, kanser hücresine karşı güçlü bir bağışıklık oluşturarak ya da genetik tekniklerle manipüle edilmiş virüsler ile kanser hücresini öldürmeyi amaçlar. Koruyucu aşılar ise onkovirüs adı verilen kanser yapıcı virüslere karşı bağışıklık sağlar.
Tedavi amaçlı geliştirilen kanser aşılarının temel çalışma prensiplerinden birisi, “virüsler” kullanılarak kanser hücrelerinin ortadan kaldırılmasıdır. Bu aşıların geliştirilmesinde kullanılan virüsler onkolitik virüs olarak adlandırılır. “Onkolitik” kelimesinin anlamı tümör yok eden şeklindedir. Bu amaçla bu virüsler sadece kanser hücresini hedef alır ve onları yok eder. Genetik teknikler ile manipüle edilmiş virüs normal hücreye girdiğinde herhangi bir zarara neden olmamaktadır. Ancak kanser hücrelerinde, hücrenin içine girerek çoğalmakta ve kanser hücresini patlatarak ölümüne neden olmaktadır.
Son zamanlarda kanser tedavi alanında pek çok onkolitik virüs aşısı geliştirilmiştir. Bunlardan çoğu halen klinik araştırma düzeyinden rutin pratik uygulamamıza taşınamamıştır. Tüm kanser türleri için geliştirilmiş tek bir onkolitik virüs aşısı bulunmamaktadır. Aşağıda, halen klinik araştırmaları süren ancak yakın zamanda onay alması beklenen onkolitik virüs aşılarını inceleyebilirsiniz.
- Talimogene laherparepvec (T-VEC, OncoVEX): melanom cilt kanseri tedavisinde FDA onayı almıştır.
- Reolysin: baş ve boyun kanserleri tedavisinde faz-3 çalışmaları devam etmekte.
- dl1520 (ONYX-015): baş ve boyun kanserleri tedavisinde faz-3 çalışmaları devam etmekte.
Bu aşılar ile ilgili temel kaygılar aşıların uzun süreli etkilerinin henüz araştırılmamış olmasıdır. Ancak son yapılan çalışmalar umut vermektedir. Birçok araştırma bu aşıların kemoterapi veya radyoterapiyle birlikte uygulanmasının etkinliğini artırdığını göstermiştir.
Tedavi edici kanser aşı çeşitleri:
Tam Tümör Hücre Aşıları
Tam Tümör hücre aşıları hastadan kanser hücrelerinin biyopsi ile alınarak izole edilmesi ve dış ortamda genetik müdahaleye tabi tutulmasını içerir. Genetik yapısı modifiye edilmiş bu hücreler hastaya enjekte edilmeden önce radyasyonla öldürülür. Böylelikle daha fazla tümör üretilmesi engellenir. Kanser hücrelerinin yüzeylerindeki antijenler bağışıklık sisteminin harekete geçmesine neden olur. Bağışıklık sistemi hücreleri olan T hücreleri bu antijenleri içeren kanser hücrelerine saldırırlar.

Tam tümör hücre aşıları hastanın kendi tümör hücrelerinden yapılabilir. Bu tip aşılar kişiye özeldir ve “Otolog” aşılar olarak isimlendirilir. Hastadan aşı yapabilmek için yeteri kadar tümör hücresi alabilmek her zaman elverişli olmayabilir. Bu yüzden aynı kanser türüne sahip farklı hastalardan alınan tümör hücreleriyle de aşı yapılabilir. Bu tip aşılara “allojenik” aşılardır.
Dendritik Hücre Aşıları
Dendritik hücreler beyaz kan hücrelerinin bir türüdür. Temel görevleri antijen üreterek vücudun enfeksiyonlarla savaşmasını sağlayan bağışıklık sistemini aktive etmektir. Dendritik aşılar kanser hücrelerinin dendritik hücrelerle laboratuvar ortamında karıştırılmasıyla elde edilir. Kanser hücrelerine ait antijenlerle aktive edilen dendritik hücreler hastaya geri gönderilerek bağışıklık sisteminin kanser hücrelerini tanımasını ve yok etmesine yardım eder. Dendritik hücre aşıları kişiye özeldir. FDA onaylı Prostat kanseri aşısı Sipuluecel-T (piyasa adı Provenge®) bu gruba örnektir.

Onkolitik Virüs ve DNA-plazmid aşıları
Kanser aşılarının etkisi zaman geçtikçe azalmaya başlar. Bunun sebebi bağışıklık sistemimizin bir süre sonra normal aktivitesine geri dönmesidir. Son yıllarda yapılan araştırmalarda DNA içeren aşıların vücudun bağışıklık sistemini daha uzun süre aktif ettiği görülmüştür. Bunun sebebi sürekli antijen üretimini sağlamasıdır.
Bilindiği üzere hücrelerin yönetim mekanizması DNA’dır. Kanser hücrelerinde DNA kanser hücresini ait proteinleri(antijenleri) üretecek genetik bilgiyi içerir. Bu DNA parçaları aşı yapmaya olanak sağlayan birden fazla antijen içerir. Laboratuvar ortamında kanser antijenlerine ait genetik bilgiyi içeren DNA, hastaya enjekte edilir. Hücreler bu DNA’yı yapılarına katarak kanser hücresine ait antijenleri üreterek, bağışıklık sisteminin aktif olarak kanser hücresini hedef almasını sağlar.
FDA onaylı melanom aşısı Talimogene Laherparepvec (piyasa adı Imlygic®) bu gruba örnektir.

Antijen / Peptid Aşıları
Antijen aşıları kanser hücrelerinin yüzeylerinde belli proteinleri veya proteinlerin kısımlarını kullanarak bağışık sisteminin aktif hale gelmesini amaçlar. Kanser antijenleri aynı zamanda aşının daha iyi çalışmasını sağlayan moleküllerle karıştırılır. Bu moleküllere adjuvan denir. Adjuvanlar vücudun hücreleri yabancı olarak tanımasını ve bağışıklık tepkisi oluşturmasına yardımcı olur. Adjuvanlara örnek olarak sitokinleri (interlökin 2) verilebilir.
Küba aşısı olarak bilinen CimaVax-EGF de bu sınıf bir kanser aşısıdır. Bu aşıda EGF adlı molekül (peptid yapıda antijen) adjuvanlarla zenginleştirilip hastaya enjekte edilir. Buna karşılık hastada antijen sunan hücreler ve antikor üreten B hücreler üzerinden bir immün yanıt oluşturulması hedeflenir. EGF, özellikle belli kanser hücrelerinin yüzeyinde yoğun bir şekilde bulunan kendi reseptörüne (EGFR) bağlanır. Aşı sonucu oluşması tetiklenen antikorların bu EGF’yi bağlayıp, EGFR reseptörünün kanser hücresine büyüme ve çoğalma sinyali vermesinin önüne geçilmeye çalışılır.

Bazı peptid aşıları sadece belli bir tür kansere karşı bağışıklık tepkisi oluşmasını sağlar. Son yıllardaki araştırmalar antijenlerin bağışıklık sistemi tarafından daha hızlı tanınması ve birden fazla antijeni tek bir aşıda toplanması üzeredir.
Anti-İdiotip Aşıları
Anti-idiotip antikorlar, belli bir antijeni taklit etmesi için üretilmiş antikorlardır. Kanser hücre yüzeyinde, kansere özgü olarak bulunan bazı antijenler (glikolipidler gibi) bağışıklık sistemi tarafından fark edilmezler. Bu yapıların bağışıklık sistemi tarafından fark edilmesini sağlamak için, bu yapıları taklit eden ve laboratuvarda üretilen anti-idiotip antikorlar kanser aşıları olarak denenmektedir. Bu aşılar bağışıklık sistemini aktive ederek, vücudun kanser hücrelerine karşı antikor üretimini sağlar. Bir başka deyişle, kanser hücre antijenleri olarak etki gösterir. Aşı enjekte edildiğinde, bağışıklık sisteminin kanser hücresi üzerinde antijenleri tanımasını sağlar.

Küba tarafından üretilen aşılara bilimsel eleştiriler
Önemle vurgulamak gerekir ki, CimaVax ve Vaxira aşıları akciğer kanserine kesin tedavi vaat etmemektedir. Aşının üreticileri de bunu özellikle vurgulamaktadırlar.
- Bu aşılar kanser hücresini direkt olarak hedef almamakta, kanserin büyümesine, çoğalmasına ve metastaz yapmasına destek olan EGF ve NeuGcGM3 moleküllerini hedef almaktadır. Bu nedenle aşının temel amacı akciğer kanserini “kronik bir hastalık” haline getirmektir.
- Aşının sunduğu bağışıklık yanıtı, bağışıklık sisteminin ana hücreleri (T-hücre, NK’lar ve makrofajlar) üzerinden değil antikorlar üzerindendir, bu nedenler oldukça kısa süreli bir fayda gözlenmektedir. Ayrıca zayıf bir immüjenite sunmaktadır. Bunun yanı sıra küçük hücreli olmayan akciğer kanseri çok sayıda antijenlere sahiptir. Bu sebeple tek bir antijeni hedef alan bu aşının tedavideki etkisi düşük olmaktadır. Akciğer kanserleri tümör mikroçevresinin oldukça etkili olduğu kanser türleridir. Tümör mikroçevresindeki farklı hücreler bağışıklık sisteminin baskılanmasını sağlar. Bu da bağışıklık sisteminin aktivitesini artıran kanser aşılarının etkisinin azalmasına yol açar.
- Sonuç olarak akciğer kanserleri için geliştirilen kanser aşılarının birçoğu, klinik çalışmalardaki düşük başarı oranları sebebiyle geri çekilmiştir.
- İlgili konu: Küba’nın kendi resmi verileri ile KÜBA’da KANSER GERÇEĞİ
4. İmmün Kontrol Noktası Blokajı (checkpoint blokaj)
Kanserli hastada zayıflamış veya kanseri göremeyen immün sistemi harekete geçirebilecek yeni fren mekanizmaları saptandı. Bunların ilk CTLA-4 idi. CTLA-4’ün engellenmesinin ilk olarak malign melanomlu hastalarda bağışıklık sistemi üzerinden tümörü küçülttüğü saptandı.
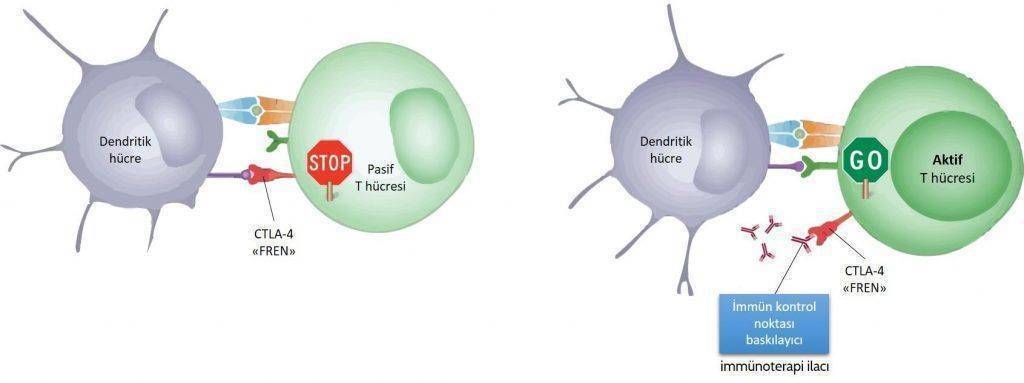
Daha sonra PD-1 ve PD-L1 adlı immün sistem üzerinde etkili başka moleküller keşfedildi ve bunlara karşı ilaçlar geliştirildi. PD-1 programlanmış hücre ölüm proteini olarak da bilinir ve immün sistem hücrelerinin yüzeyinde bulunan bir reseptördür. Bu reseptöre kanser hücresinden salınan PD-L1 ve PD-L2 adlı protein yapısındaki ligandlar bağlanarak kansere yönelik immün sistemin fren mekanizmasını çalıştırır. Pembrolizumab ve Nivolumab bu protein yapılara bağlanarak immün sistemin fren mekanizmasının çalışmasına izin vermez. Serbest kalan immün hücreler kanseri tanımak ve yok etmek üzere harekete geçer.
5. Hücresel Tedaviler
Tümör infiltre eden modifiye lenfositler
Adoptif T hücre transferinin amacı hastanın kendi T hücrelerini kanserle savaşmasını sağlamaktır. Bu amaçla T hücreleri hastadan izole edilir ve genetik teknikler uygulanarak T hücrelerinin kanser hücrelerine karşı aktif hale getirilir. Daha sonra modifiye edilmiş bu hücreler hastaya geri gönderilir. Bağışıklık sisteminin aktif hale gelmesi amaçlanır.
CAR T-hücreler
Yine başka yeni bir strateji, kimerik antijen reseptörü (CAR) T hücreli tedavidir. Bu tedavide hastadaki T hücreleri toplanarak laboratuvar ortamında tekrar programlanır ve hastaya tekrar aşılanır. Yeniden programlanmış T hücreleri vücutta bulunan kanser hücrelerini kolaylıkla bulan ve saldıran belli proteinler üretirler. Elde edilen ilk sonuçlar, zor tedavi edilen çeşitli kan kanserlerinin (lösemi), CAR T hücreli tedaviden fayda görebileceği yönündedir. Örneğin: CD-19’a yönelik CAR T hücreleri, yüzeylerinde CD19 molekülleri olan kötü huylu (malign) B hücrelerine saldırması için programlanır.
ALL tekrarlamış olan yetişkin ve çocuklarla yapılan bir çalışmada, 30 hastanın 27’sinde bu yeni tedaviyi aldıktan sonra tam remisyon (hastalık bulgularının tamamen ortadan kalkması) sağlandığı, remisyonun uzun süreli olduğu ve 2 yıl boyunca sürdüğü görülmüştür. Genel olarak CAR T hücreleri alan hastaların 78%’i 6 ay yaşamıştır.
Başka bir araştırmada, kemoterapiye dirençli, diffüz büyük B hücreli lenfoma (DLBCL) ve diğer kan kanseri türlerine sahip 15 hastanın 12’si CD-19’a yönelik CART T hücrelerine yanıt vermiş ve 8 hastada kanser tamamen yok olmuştur.
CAR T hücreli tedavinin gelecekte çok daha geniş kapsamlı kullanılacağı düşünülmektedir. Ayrıca bu amaçla sadece T-hücreelr değil, NK ve makrofajların da denendiği araştırmalar vardır.
6. Fotoimmünoterapiler
Fotoimmünoterapi, kızılötesi (infrared) ışık kullanarak sadece kanser hücrelerini hızlı bir şekilde ve sağlıklı hücrelere zarar vermeden yok etmeyi hedefleyen bir tedavi türüdür.
Fotoimmünoterapide araştırmacılar kansere özgü reseptörleri tanıyan monoklonal antikorlara bağlanan ve belli bir dalga boyunda ışığı absorbe eden moleküller geliştirmiştir. Bu moleküllerin özelliği kanser hücresinin yüzeyindeki hedef reseptöre bağlandığında uç kısmındaki ışık absorbe eden molekülün aktif hale gelmesidir. Fotoimmünoterapi tedavisi hakkında daha detaylı bilgi için tıklayınız.
7. Hipertermi
Doğal bağışıklık yanıt olan ateş çıkarmak için hipertermi yöntemleri, özellikle Tüm Vücut Hipertermi kullanılmaktadır. Bu yöntemde deriye zarar vermeyen ve derinlik etkili su filtreli infrared-A ışını yayan lambalar doğrudan karın ve gövdeye yöneltilir. Yapılan çalışmalar bağışıklık sisteminin aktifleşmesi için en uygun vücut ısısı değerlerinin 39 °C – 40 °C olduğunu gösterdiği için, kanser tedavisinde hedef vücut ısısı “orta” tüm vücut hipertermi olarak da nitelendirilen 39 °C – 40 °C arasıdır. Tedavi, vücudun verdiği tepkiye ve hedef ısıya ulaşılma süresine göre değişebilmekle birlikte, ortalama 4 saat kadar sürmektedir.
İlgili Konu: Hipertermi Nedir? Kanser Tedavisinde Yeri Var mı?
8. Kombinasyonlar: Kanser İmmünoterapisinin Geleceği
İmmünoterapinin belki de en büyük avantajı tümörü değil de immün sistemi hedef almasıdır. Çünkü tümör çok hızlı yeni mutasyonlar geliştirir ve klasik tedavilere (kemoterapi gibi) direnç geliştirebilir. Kemoterapi birinci basamak tedavide (buna tedavinin ilk raundu da denilebilir), neredeyse tüm kanser hücrelerini yok edebilir, fakat çoğunlukla az sayıda hücre kalır; bu sağ kalan kanser hücreleri kanserde hastalık tekrarının ve ilaç dirençliliğinin ana kaynağıdır.
Zıt olarak immün sistem, tümörle birlikte evrimleşebilir ve tümördeki değişikliklere adapte olabilir. Eğer kanser hücrelerinde yeni bir mutasyon olursa, immün sistem yeni kansere-spesifik T-hücreleri geliştirilebilir. Sonuç olarak immünoterapi daha uzun vadeli, kararlı, hatta potansiyel olarak tam şifaya ulaştırabilen tedaviler vaat etmektedir. Örnek olarak, CTLA-4 immün kontrol noktası baskılayıcıları ile tedavi edilen ilk cilt kanseri – malign melanom hastalarından bazıları, 10 yıldan daha uzun süredir hastalık bulguları olmadan yaşamaya devam etmektedirler.
Fakat immünoterapilerin özellikle tek başlarına kullanıldıklarında işe yaradıkları hasta oranı halen birçok kanser türü için arzu edilen düzeyde değildir. Bu noktada kombinasyon immünoterapileri devreye girmektedir.
İmmünoterapileri, kemoterapi ve radyoterapi gibi artık klasik hale gelen kanser tedavileri ile kombine etmek bir diğer güçlü tedavi seçeneği olarak karşımızda durmaktadır. Bu konvansiyonel metodlar tümörün bağışıklık sistemi tarafından daha kolay tanınmayı sağlayan proteinleri açığa çıkartarak tümör antijenitesini artırabilirler ve immünoterapinin tamamlayıcısı olabilirler. Tümör hücreleri kemoterapi veya radyoterapi tarafından öldürüldüklerinde, genetik içeriklerini vücuda salarlar ve bağışıklık sistemi hücrelerimiz bu tümör ürünlerini temizler; bu antijen sunum sürecini tetiklemek için iyi bir yol olabilir.
Hatta bir grup bilim insanının görüşüne göre tüm başarılı kanser tedavileri aslında birer immünoterapidir. Peki sözle ne demek istiyorlar? Bu savı savunanlara göre kemoterapi veya radyoterapi kanseri tamamen yok etmeye çalışır fakat geride kalan hücreleri esas olarak aktifleşen immün sistem temizler, bu da hastalık tekrarını (nüks) engelleyen şeydir.
Sonuç
Sonuç olarak immünoterapinin kanser tedavisi için güçlü ve umut vaat eden bir yol olduğu her geçen gün daha iyi anlaşılmaktadır. Bununla birlikte immünoterapilere de direnç gelişebildiği, immünoterapilerin her kanser türünde belirgin bir fayda yakalayamadığı ve etkisinin kişiden kişiye değişebildiği unutulmamalıdır. Bu açıdan kombinasyon tedavileri, gen terapisi gibi yeni yaklaşımlar bu sorunların üstesinden gelmede yardımcılarımız olabilir. Bir diğer konu ise immünoterapilerin (özellikle immün kontrol noktası baskılayıcılar) maliyetinin şu an için oldukça yüksek olmasıdır. Temennimiz odur ki, hükümetler ve ilaç firmaları bu konuda uzlaşarak immünoterapiler daha fazla sayıda hasta ve çeşitte kanser türünde denenmeli ve gerçek potansiyeli ortaya çıkarılmalıdır.



