Opdivo (nivolumab) İmmünoterapisi Nedir? Hangi Kanserlerde Etkilidir?
Opdivo nedir?
Opdivo (etken maddesi nivolumab), bağışıklık sisteminin, kanser hücrelerini hedef alma ve öldürme yeteneğini geliştirmek için tasarlanmış bir immünoterapi ilacıdır. İlk olarak 1992 yalında Japonya’da Kyoto Üniversitesinde Profesör Hanjo ve arkadaşları tarafından keşfedilmiştir ve bu keşif süreci 2018 Nobel Tıp Ödülü'ne layık görülmüştür. Kanserde ilk ABD Gıda ve İlaç İdaresi (FDA) onayısnı ise Aralık 2014'te melanom tedavisi için almıştır. Bugün ise 9 farklı kanser türünde FDA onaylıdır; ülkemizde ise 6 farklı kanser türünde ruhsatlı ve 4 farklı kanser türünde geri ödemeye sahiptir.
NOT: Önemli bir gelişme olarak 8 Şubat 2022'de Opdivo, ileri evre küçük hücreli dışı akciğer kanserinin ikinci basamak tedavisi olarak SGK (Sosyal Güvenlik Kurumu) tarafından geri ödeme kapsamına alındı. Böylelikle ülkemizde, akciğer kanseri için ilk kez ve tek olarak bir immünoterapi ilacı, bedeli kurum tarafından karşılanacak şekilde hastaların kullanımına sunuldu.
Opdivo Fiyat Nedir?
Opdivo immünoterapisi 14 günde bir kullanılır. Her kürde 240 mg kullanılır (2 adet 100 mg ve 1 adet 40 mg).
Temmuz 2025 itibarı ile
- 100 mg Opdivo parekende satış bedeli bedeli yaklaşık 38053,16 ₺
- 40 mg Opdivo parekende satış bedeli bedeli yaklaşık 15221,26 ₺
Bu durumda 240 mg bedeli 91.327,58 ₺
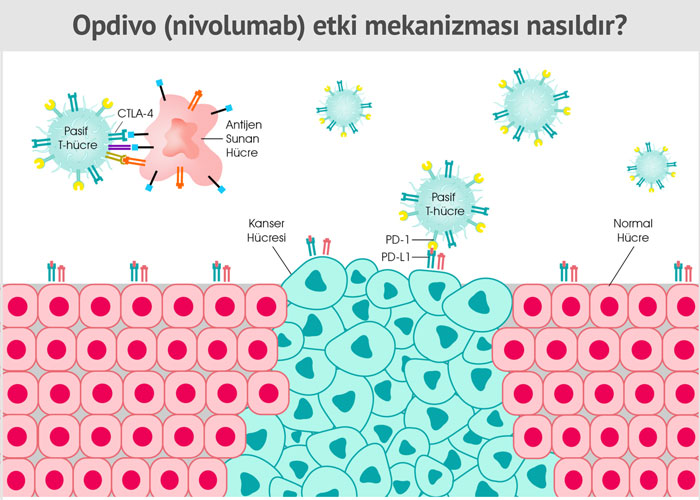
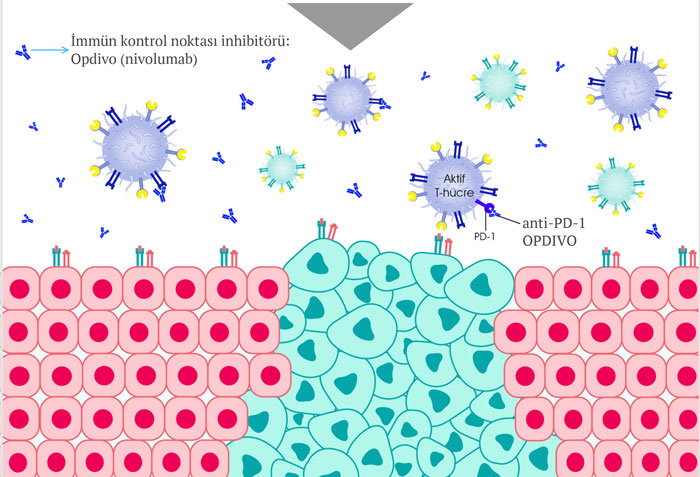
Opdivo etki mekanizması nasıldır?
Opdivo, bağışıklık sisteminin T hücreleri üzerinde bulunan PD-1 reseptörlerini etkilemektedir. PD-1, uyarıcı molekülü olan PD-L1 ile bağlandığında bağışıklık hücrelerini, dolayısı ile bağışıklık sistemi pasifleştiren bir yüzey molekülüdür. PD-1 ve PD-L1 etkileşimi, bağışıklık sisteminin kontrol noktalarından biridir.
Opdivo, PD-1 ile bağlanır ve PD-1'in PD-L1 ile bağlanmasını engelleyerek bağışıklık sisteminin aktif olmasını sağlar. Böylece bağışıklık sistemi hücrelerimiz kanser hücrelerine karşı aktifleşir. Bununla birlikte bu yöntem tüm kanser türlerinde işe yaramaz, çünkü kanser hücrelerinin, bağışıklık sisteminden gizlenmek için bu kontrol noktasından başka hücresel mekanizmalar da kullanır.
Opdivo genellikle tümörleri küçültmek ve hastalığın belirtilerini azaltıp hastanın yaşam süresini (sağkalım) uzatmak amacıyla verilir.
Opdivo'nun FDA onaylı endikasyonları cilt kanseri melanom, akciğer kanseri, böbrek kanseri, hodgkin lenfoma, baş-boyun kanseri, üretelyal (idrar yolları) karsinom, kolorektal (kalın bağırsak) kanser, hepatoselüler (karaciğer) karsinom ve özofagus (yemek borusu) kanseridir.

Opdivo FDA onay tarihleri
- 22 Aralık 2014: İleri evre (metastatik) melanom tedavisi.
- 4 Mart 2015: İleri evre platin-bazlı kemoterapi tedavisi sırasında veya sonrasında progresyon (ilerleme) gelişmiş yassı hücreli küçük hücreli olmayan akciğer kanseri tedavisi.
- 1 Ekim 2015: Yervoy (etken madde ipilimumab) ile birlikte BRAF V600 wild tip cerrahi olarak çıkarılamayan veya metastatik melanomlu hastaların tedavisi.
- 9 Ekim 2015: İleri evre platin bazlı kemoterapi tedavisi sırasında veya sonrasında progresyon gelişmiş küçük hücreli olmayan akciğer kanseri tedavisi.
- 23 Kasım 2015: Daha önce antianjiyojenik tedavi almış metastatik renal hücreli karsinom hastaların tedavisi.
- 23 Ocak 2016: Yervoy ile birlikte BRAF V600 wild tip ve V600 mutasyonu pozitif cerrahi ile çıkarılamayan veya metastatik melanomlu hastaların tedavisi.
- 17 Mayıs 2016: Otolog hematopoetik kök hücre nakli ve brentuksimab ventodin sonrası sonrası tekrarlayan veya ilerleyen klasik Hodgkin lenfoma hastalarının tedavisi.
- 10 Kasım 2016: Platin bazlı kemoterapi tedavisi sırasında veya sonrasında progresyon gelişmiş tekrarlayan veya metastatik yassı hücreli baş boyun kanseri tedavisi.
- 2 Şubat 2017: Platin içeren kemoterapi sırasında veya sonrasında hastalık progresyonu gösteren veya platin içeren kemoterapi ile neoadjuvan veya adjuvan tedaviden sonraki 12 ay içinde hastalık progresyonu gösteren bölgesel olarak ilerlemiş veya metastatik ürotelyal (idrar yolları) karsinom tedavisi.
- 31 Temmuz 2017: Floropirimidin, oksaliplatin ve irinotekan ile tedaviyi takiben ilerlemiş MSI-H veya dMMR metastatik yetişkin ve 12 yaş üzeri pediatrik kolorektal kanseri tedavisi.
- 22 Eylül 2017: Daha önce sorafenib ile tedavi edilmiş olan hepatoselüler (karaciğer) karsinom tedavisi.
- 20 Aralık 2017: Lenf noduna yayılımı olan veya metastatik melanomlu hastaların tam cerrahi çıkarımı sonrası adjuvan tedavisi.
- 6 Mart 2018: Çoğu FDA onaylı endikasyonları için Nivolumab uygulama dozunun 4 haftada bir 480 mg olarak da verilebilmesi.
- 16 Nisan 2018: Yervoy ile birlikte daha önce tedavi almamış orta veya zayıf riskli ilerlemiş renal hücreli (böbrek) karsinom tedavisi.
- 10 Temmuz 2018: Yervoy ile birlikte, floropirimidin, oksaliplatin ve irinotekan ile tedaviyi takiben ilerleyen MSI-H veya dMMR metastatik yetişkin ve 12 yaş üzeri pediatrik kolorektal kanseri tedavisi.
- 16 Ağustos 2018: Platin bazlı kemoterapi ve en az başka bir tedavi sonrası kanseri ilerlemiş metastatik küçük hücreli akciğer kanseri tedavisi.
- 15 Mayıs 2020: EGFR veya ALK genomik tümör anormallikleri olmayan, FDA onaylı bir testle ispatlanmış PD-L1 pozitif (≥% 1) tümör ekspresyonu olan, metastatik küçük hücreli dışı akciğer kanseri olan yetişkin hastaların birinci basamak tedavisinde Yervoy ile birlikte.
- 26 Mayıs 2020: EGFR veya ALK genomik tümör anormallikleri olmayan tekrarlayan veya metastatik küçük hücreli dışı akciğer kanseri olan yetişkin hastaların birinci basamak tedavisinde 2 kür platin içeren kemoterapi ve Yervoy ile birlikte.
- 10 Haziran 2020: Daha önce floropirimidin ve platin bazlı kemoterapi uygulanmış rezeke edilemeyen ilerlemiş, tekrarlayan veya metastatik özofagus yassı hücreli karsinomu olan hastaların tedavisinde PD-L1'den bağımsız onay aldı.
- 16 Nisan 2021: İlerlemiş veya metastatik mide, gastroözofageal bileşke ve özofagus adenokarsinomu için floropirimidin ve platin içeren kemoterapi ile kombinasyon halinde onay aldı. Bu, mide kanserinin birinci basamak tedavisi için FDA onaylı ilk immünoterapidir.
- 20 Mayıs 2021: Tamamen rezeke edilmiş özofagus veya GEJ (gastro-özofageal bileşke) kanserine sahip ve neoadjuvan kemoradyoterapi almış almış rezidüel patolojik hastalığı olan hastaların adjuvan tedavisi için onaylandı.
- 19 Mayıs 2021: Önceki neoadjuvan kemoterapi, nodal tutulum veya PD-L1 durumundan bağımsız olarak, radikal ameliyat sonrası nüks riski yüksek olan ürotelyal (mesane ve idrar yolları) karsinomlu hastaların adjuvan tedavi olarak onaylandı.
- 20 Ağustos 2021: FDA, Opdivo (nivolumab) ilacını yüksek riskli ürotelyal karsinom hastaları için adjuvan tedavi olarak onayladı.
- 7 Mart 2022: FDA, Opdivo (nivolumab) + kemoterapi kombinasyonunu, rezeksiyona uygun küçük hücreli dışı akciğer kanseri olan bazı yetişkin hastalarda neoadjuvan tedavi olarak onayladı.
- 30 Mayıs 2022: FDA, Opdivo (nivolumab) bazlı iki rejimi rezeksiyona uygun olmayan ileri veya metastatik özofagus skuamöz hücreli karsinomda birinci basamak tedavi olarak onayladı.
- 13 Ekim 2023: FDA, Opdivo (nivolumab) ilacını tamamen rezeksiyon yapılmış evre IIB veya IIC melanom hastalarında adjuvan tedavi olarak onayladı.
- 7 Mart 2024: FDA, Opdivo (nivolumab) kombinasyonunu sisplatin ve gemsitabin ile birlikte, rezeksiyona uygun olmayan veya metastatik ürotelyal karsinomlu yetişkin hastalarda birinci basamak tedavi olarak onayladı
- 3 Ekim 2024 : ABD Gıda ve İlaç Dairesi (FDA), rezeksiyona uygun küçük hücreli dışı akciğer kanseri (KHDAK) hastalarında neoadjuvan Opdivo (nivolumab) ve kemoterapi, ardından cerrahi ve adjuvan tek ajan Opdivo perioperatif tedavisini onayladı.
- 8 Nisan 2025: FDA, Opdivo (nivolumab) + Yervoy (ipilimumab) kombinasyonunu daha önce tedavi almamış, mikrosatellit instabilitesi yüksek veya DNA uyumsuzluk tamir bozukluğu (MSI-H/dMMR) olan rezeksiyona uygun olmayan veya metastatik kolorektal kanser hastaları için tedavi olarak onayladı.
- 11 Nisan 2025: FDA, Opdivo (nivolumab) + Yervoy (ipilimumab) kombinasyonunu rezeksiyona uygun olmayan veya metastatik hepatoselüler karsinom için birinci basamak tedavi olarak onayladı.
Opdivo, Türkiye'de Hangi Durumlarda SGK Geri Ödeme Kapsamındadır?
Nivolumab Türkiyede 19.04.2017 de Ruhsat almıştır.
1. Malign Melanom – Birinci Basamak Tedavi
-
Endikasyon: Lokal ileri veya metastatik, cerrahi olarak rezeke edilemeyen malign melanom
-
Koşullar:
-
ECOG performans skoru 0–1
-
Daha önce hiç immünoterapi (IO) almamış olmak
-
-
Kullanım Şekli: Monoterapi
-
Süre: Hastalık progresyonuna kadar
2. Malign Melanom – Adjuvan Tedavi
-
Endikasyon: Evre III–IV malign melanomda tam rezeksiyon sonrası lenf nodu tutulumu olan hastalar
-
Koşullar:
-
ECOG 0–1
-
-
Kullanım Şekli: Monoterapi
-
Süre: Maksimum 12 ay
3. Böbrek Hücreli Kanser (mRCC) – Üçüncü Basamak
-
Endikasyon: Metastatik berrak hücreli böbrek hücreli kanser (RCC)
-
Koşullar:
-
Daha önce en az bir VEGF hedefli tedavi almış olmak
-
Toplamda en fazla 3 sistemik tedavi almış olmak
-
Karnofsky performans skoru ≥70
-
Daha önce IO almamış
-
-
Kullanım Şekli: Monoterapi
-
Süre: Progresyona kadar
4. Klasik Hodgkin Lenfoma – Üçüncü Basamak ve Ötesi
-
Endikasyon: Nüks/refrakter klasik Hodgkin lenfoma
-
Koşullar:
-
OKHN sonrası progresyon gelişmiş olması
-
Brentuksimab vedotin sonrası hastalık devam ediyor olması
-
Daha önce en az 3 sistemik tedavi almış olmak
-
Hematoloji veya medikal onkoloji uzmanı raporu ile 3 aylık kullanım onayı
-
Yenilemelerde kısmî klinik yanıt aranır
-
-
Kullanım Şekli: Monoterapi
5. Baş-Boyun Skuamöz Hücreli Kanseri – İkinci Basamak
-
Endikasyon: Operabl olmayan lokal ileri veya metastatik baş-boyun skuamöz hücreli kanser
-
Koşullar:
-
Kemoradyoterapi sonrası 6 ay içinde nüks
-
Veya doğrudan metastatik başlangıç durumu
-
Daha önce platin bazlı kemoterapi almış ve sonrasında 6 ay içinde nüks
-
-
Kullanım Şekli: Monoterapi
6. Özofagus Skuamöz Hücreli Kanseri – Metastatik veya Lokal İleri, İkinci Basamak
-
Endikasyon: Skuamöz hücreli özofagus kanseri
-
Koşullar:
-
Platin + fluoropirimidin kemoterapisi sonrası progresyon
-
Daha önce immünoterapi almamış olmak
-
-
Kullanım Şekli: Monoterapi
-
Süre: Progresyona kadar
7. Kolorektal Kanser – MSI-H veya dMMR – İkinci Basamak
-
Endikasyon: Mikrosatellit instabilitesi yüksek (MSI-H) veya DNA yanlış eşleşme onarım bozukluğu (dMMR) pozitif metastatik kolorektal kanser
-
Koşullar:
-
ECOG 0–1
-
Fluoropirimidin, irinotekan ve oksaliplatin sonrası progresyon
-
Daha önce IO almamış
-
-
Kullanım Şekli: Monoterapi
-
Süre: Progresyona kadar
8. Gastroözofageal Bileşke / Mide Adenokanseri – CPS ≥5 – Birinci Basamak
-
Endikasyon: Metastatik veya lokal ileri mide veya gastroözofageal bileşke adenokanseri
-
Koşullar:
-
PD-L1 CPS ≥5, HER2 negatif
-
ECOG 0–1
-
Kombine tedavi: Nivolumab + platin + fluoropirimidin
-
Neoadjuvan veya adjuvan tedavi aldıysa, tedavi bitiminden itibaren ≥6 ay hastalıksız süre
-
-
Süre: En fazla 24 ay
9. Küçük Hücreli Dışı Akciğer Kanseri (KHDAK) – Neoadjuvan (Evre 3A)
-
Endikasyon: Evre 3A, rezeke edilebilir KHDAK
-
Koşullar:
-
PD-L1 ≥ %1
-
Platin bazlı ikili KT + Nivolumab (maks. 3 kür)
-
Non-skuamöz tipte: EGFR/ALK/ROS testi negatif olmalı
-
Skuamöz tipte bu test zorunlu değil
-
-
Kullanım Şekli: Kombine (KT + IO), neoadjuvan
10. KHDAK – Metastatik veya Lokal İleri, İkinci Basamak
-
Endikasyon: Metastatik veya lokal ileri küçük hücreli dışı akciğer kanseri
-
Koşullar:
-
ECOG 0–1
-
Daha önce platin bazlı kemoterapi almış olmak
-
-
Kullanım Şekli: Monoterapi
-
Süre: Progresyona kadar
Opdivo uygulama şekli ve dozu nasıldır?
Opdivo'nun en yaygın kullanım şekli, 2 haftada bir 240 mg veya 4 haftada bir 480 mg şekildedir. Bununla birlikte Yervoy ile kombine ve çocuk hastlarda kullanım dozu değişebilmektedir.
Cerrahi ile çıkarılamayan veya metastatik melanom
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
- Nivolumab 3 mg/kg ardından ipilimumab 1 mg/kg aynı gün 3 haftada bir 4 doz(kür), daha sonra tek ilaç (monoterapi) nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Melanomun adjuvan tedavisi
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Metastatik küçük hücreli olmayan akciğer kanseri
- Nivolumab 2 haftada bir 3 mg/kg ile 6 haftada bir 1 mg/kg ipilimumab
- Nivolumab 3 haftada bir 360 mg ile 6 haftada bir 1 mg/kg ipilimumab ve 2 kür platin-ikili kemoterapi.
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Küçük hücreli akciğer kanseri
- Nivolumab 2 haftada bir 240 mg.
İleri evre renal hücreli karsinom
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
- Nivolumab 3 mg/kg ardından ipilimumab 1 mg/kg aynı gün 3 haftada bir 4 doz(kür), daha sonra tek ilaç (monoterapi) nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Klasik Hodgkin Lenfoma
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Tekrarlayan veya metastatik skuamöz hücreli baş boyun kanseri
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Lokal ileri veya metastatik ürotelyal karsinom
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Mikrosatellit instabilitesi-yüksek (MSI-H) veya hatalı onarım yetersizliği (dMMR) metastatik
kolorektal kanser
- Yetişkin ve pediyatrik hastalar ≥40 kg nivolumab 2 haftada bir 240 mg veya her 4 haftada 1 480 mg.
- Pediyatrik hastalar <40 kg nivolumab 2 haftada bir 3 mg/kg.
- Yetişkin ve pediatrik hastalar ≥40 kg Nivolumab 3 mg/kg ardından ipilimumab 1 mg/kg aynı gün 3 haftada bir 4 doz(kür), daha sonra tek ilaç (monoterapi) nivolumab 2 haftada bir 240 mg.
Hepatosellüler Karsinoma
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
- Nivolumab 3 mg/kg ardından ipilimumab 1 mg/kg aynı gün 3 haftada bir 4 doz (kür), daha sonra tek ilaç (monoterapi) nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Özofagus skuamöz hücreli karsinom
- Nivolumab 2 haftada bir 240 mg veya 4 haftada bir 480 mg.
Opdivo uygulama süresi ve tekniği nasıldır?
Opdivo her kürün 1. günü en az 30 dakika boyunca intravenöz infüzyon (toplardamar içine) şeklinde uygulanır. Opdivo'nun uygulama süresi kanser klinik araştırmalarına dayanmaktadır ancak doktor tercihine veya hastanın toleransına göre de değişebilir. Kortikosteroid, antihistaminik veya hidrasyon (sıvı desteği) gibi premedikasyon denilen ön ilaçlar verilmesi veya Yervoy ve kemoterapi gibi eş zamanlı uygulanması gereken ilaçlar var ise toplam tedavi süreniz artabilir.
Opdivo genellikle günübirlik ayakta tedavi merkezlerinde uygulanır ve tedavinizin sonunda eve gitmenize izin verir.
Opdivo tedavisi, hastalıkta ilerleme veya kabul edilemez bir yan etki gözlenene kadar sürdürülür.
Opdivo'nun en sık (≥%20) görülen yan etkileri nelerdir?
- yorgunluk
- döküntü
- kaslarda, kemiklerde ve eklemlerde ağrı
- kaşınan cilt
- ishal
- mide bulantısı
- zayıflama
- öksürük
- kusma
- nefes darlığı
- kabızlık
- iştah azalması
- sırt ağrısı
- üst solunum yolu enfeksiyonu
- ateş
- baş ağrısı
- mide bölgesi (karın) ağrısı
Aşağıdaki grafikte, Opdivo'nun en sık görülen yan etkilerinin ortaya çıkış ve sonlanma zamanları görülebilir:

Ne sıklıkla izleme gerekli?
Kan testleri, tedaviden önce yapılmalı ve ardından Opdivo tedavisine devam edildiği sürece periyodik olarak kontrol edilmelidir. Kan testleri genellikle tam kan sayımı, kapsamlı metabolik panel, magnezyum, amilaz, lipaz, adrenokortikotropik hormon, serum kortizol seviyesi, tiroid fonksiyonları ve hepatit taramalarını içermektedir. Bunlara ek olarak doktorunuzun isteyebileceği tetkikler olabilir.
Görüntüleme ne sıklıkla gereklidir?
Görüntüleme Opdivo tedavisine başlamadan önce mutlaka yapılmalıdır. Kanserin türüne göre değişebilmekle birlikte genellikle tedaviye başladıktan 8 hafta sonra görüntüleme yapılır. Sonrasında yine kanserin türüne göre değişebilmekle birlikte Opdivo tedavisi devam ettiği sürece her 6-12 haftada bir kontrol için görüntüleme tekrarlanır. Doktorunuzun önerisine göre daha erken veya geç yapılabilir.
Görüntüleme X ışınları, manyetik rezonans görüntüleme (MRI), bilgisayarlı tomografi (CT) taramaları veya pozitron emisyon tomografisi (PET) taramalarını içerebilir.
Kan testi sonuçları / görüntüleme tedaviyi nasıl etkileyebilir?
Sonuçlara bağlı olarak, doktorunuz Opdivo tedavisine planlandığı gibi devam edebilir, tedaviyi erteleyebilir veya tedaviyi değiştirebilir.
Opdivo kullanırken dikkat edilmesi gerekenler
- Opdivo tedavinizin infüzyonu sırasında eğer alerjik bir reaksiyon gözlenirse, alerjik reaksiyonu azaltmak için antihistaminik veya kortikosteroid (metilprednizolon, prednizon gibi) verilebilir.
- Tedaviyi erteledikten sonra geçmeyen veya steroidlerle 3 ila 5 gün sonra belirgin şekilde iyileşmeyen ishal gibi bide-bağırsak belirtileri yaşıyorsanız, tedavinize ek olarak infliximab (Remicade®) verilebilir.
- Tedaviyi erteledikten sonra geçmeyen veya steroidlerle 3 ila 5 gün sonra önemli ölçüde iyileşmeyen bağışıklık reaksiyonlarından kaynaklanan karaciğer toksisitesi yaşarsanız, mikofenolat mofetil (CellCept®) verilebilir.
- Ateşiniz olursa, antiinflamatuar ilaçlar (örneğin: ibuprofen veya naproksen) ile kontrol altına alınabilir. Doktorunuza veya eczacınıza bu ilaçların nivolumab tedavisi ile alınmasının güvenli olup olmadığını sorun.
- İlaç etkileşimlerini önlemek için Opdivo tedaviniz haricinde kullandığınız herhangi bir ilaç var ise mutlaka doktorunuz veya eczacınıza bildiriniz.
1. Rizvi NA, Mazieres J, Planchard D, et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial. Lancet Oncol. 2015;16:257-265.
2. Larkin J, Chiarion-Sileni V, Gonzalez R, et al. Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med. 2015;373:23-34.
3. Postow MA, Chesney J, Pavlick AC, et al. Nivolumab and ipilimumab versus ipilimumab in untreated melanoma. N Engl J Med. 2015;372:2006-2017.
4. Opdivo FDA Approval History. https://www.drugs.com/history/opdivo.html