31 Temmuz 2017'de ABD Gıda ve İlaç Dairesi FDA, fluoropirimidin, oksaliplatin ve irinotekan tedavisi sonrasında hastalığı ilerlemeye devam etmiş, DNA tamir genlerindeki yetersizlik (Mismatch Repair System, dMMR) ve mikrosatellit instabilitesi yüksek (MSI-H) olan 12 yaş ve üzeri metastatik kolorektal kanserli hastaların tedavisinde bir immünoterapi ilacı olan Nivolumab'a (piyasa adı Opdivo) hızlandırılmış onay verdi.
Mikrosatellitler: DNA, her bir nükleotidin karşısına eş nükleotit (örn: adenin (A) karşısına timin (T); sitozin (C) karşısına guanin (G)) getirilerek kopyalanır. 3 milyar nükleotidin eşleştiği bir DNA kopyalanmasında bazı hatalar (örn. yanlış eşleşmeler) olabilmektedir. Bunlar normalde DNA tamir genleri tarafından bulunup onarılmaktadır. Fakat bazı kanserlerde hatalı eşleşmeler onarılamaz ve bu durum mismatch repair defekti olarak adlandırılır. Mikrosatellit olarak adlandırılan eşleşemeyen bu DNA dizileri tekrarlanıp birikir ve mutasyonlara neden olarak genomik kararsızlık oluşturur.
Bu FDA onayı, genetik analiz ile belirlenmiş dMMR veya MSI-yüksek olan ve daha önce fluoropirimidin, oksaliplatin ve irinotekanın bazlı kemoterapi tedavisi sırasında veya sonrasında tedavilere rağmen hastalığı ilerlemiş veya bu tedavileri tolere edememiş 53 metastatik kolorektal ( kalın bağırsak ) kanserli hastada yapılan, çok merkezli, açık etiketli, tek kollu çalışma verilerine dayandırılmaktadır. Çalışmaya dahil edilen hastalar metastatik hastalığı için daha önce en az bir kez fluropiriminle kombine oksaliplatin veya irinotekan almış 74 metastik kolerektal kanseri hastanın büyük bir kısmını oluşturmaktadır.
Tüm hastalara, kabul edilemez yan etkiler oluşmasına veya radyolojik olarak hastalığı ilerlemeye devam ettiği gösterilene kadar her iki haftada bir toplardamar (intravenöz) infüzyonla 3 mg/kg nivolumab uygulanmıştır.
Bağımsız radyolojik inceleme komitesi tarafından değerlendirilen objektif yanıt oranı, önceden fluoropirimidin, oksaliplatin ve irinotekan alan 53 hastada %28 (n=15 hasta) bulunmuştur. Hastaların %67’sinde yanıtın en az 6 ay sürdüğü rapor edilmiştir. Bir hastada tam yanıt ve 14 hastada ise kısmi yanıt gözlenmiştir. Objektif yanıt oranı, genel nüfustaki 74 hastada ise %32 (n = 24 hasta) olarak bildirilmiştir.
Pediyatrik (çocuk) hastalarda nivolumab çalışması yapılmamıştır. MSI-yüksek veya dMMR’li 4. evre kalın bağırsak kanseri olan ergenlik çağındaki (12 yaşında ve üzeri) hastalar için etkinlik, ilgili erişkin nüfustaki sonuçlardan çıkarılmıştır.
Tek ajan olarak kullanılan nivolumabın en sık rastlanan yan etkileri yorgunluk, döküntü, kas iskelet sistemi ağrısı, kaşıntı, ishal, bulantı, öksürük, nefes almada güçlük, kabızlık, iştah azalması, bel ağrısı, eklem ağrısı, üst solunum yolu enfeksiyonu ve ateştir.
İlginizi Çekebilir:
Bu endikasyon için önerilen nivolumab dozu, her 2 haftada bir 240 mg'dır.
Nivolumab Etki Mekanizması Nasıldır?
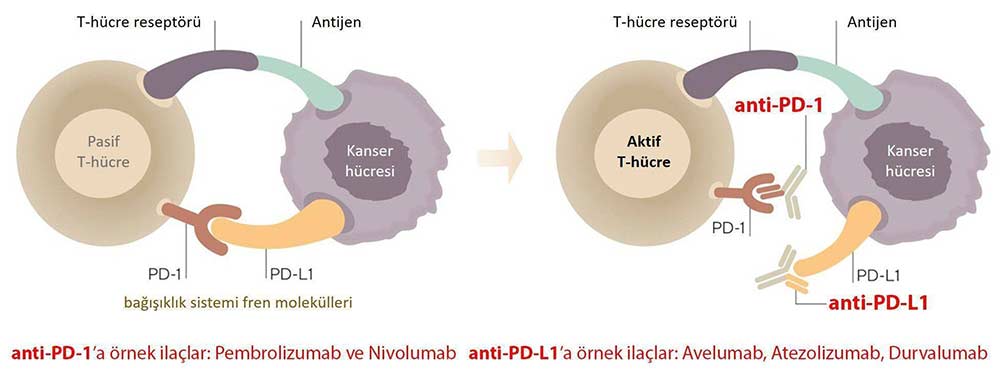
Nivolumab adlı immünoterapi ilacı, bağışıklık sistemi hücrelerinin kanser hücrelerine daha etkili saldırmasını sağlayan bir bağışıklık sistemi kontrol noktası inhibitörüdür. PD-1/PD-L1 etkileşimini hedef alarak kanser hücresinin bağışıklık sistemi hücreleri tarafından “dost” olarak algılanmasını engeller.
İlginizi Çekebilir: