Mesane Kanseri için İlk Kez Bir Gen Terapisi FDA Onayı Aldı
FDA (ABD Gıda ve İlaç Dairesi), 16 Aralık 2022'de Adstiladrin (nadofaragene firadenovec-vncg) adlı bir gen terapisini mesane (idrar kesesi) kanseri için onayladı. Bu tedavi, Bacillus Calmette-Guérin (BCG) tedavisine dirençli yüksek riskli, kas tabakasına yayılmamış mesane kanseri olan yetişkin hastalar için önerilen, insan hücrelerinde çoğalmayan adenoviral vektör tabanlı bir gen terapisidir.
Mesane kanserlerinin çoğu erken evrede tanı alır, fakat tekrarlama ve yayılma riski yüksektir.
Mesane kanseri, yaygın olan kanser türlerinden biridir ve bu hastalıkta kanser çoğunlukla mesanenin iç tabakasında başlar. Zamanla, kanserli hücreler metastaz (yayılım) yapabilir. Yeni tanı konulan mesane kanserlerinin %75-%80'i erken aşamadadır ve henüz mesanenin kas tabakasına yayılmamıştır. Bu tür mesane kanserlerine kasa-invaze olmayan mesane kanseri denir (non-muscle-invasive bladder cancer, NMIBC). Bu tür kanser, yüksek tekrarlama riskine (%30-%80 arasında) ve metastaz yapma riskine sahiptir.
Aşağıda, mesanenin anatomisi ve mesane kanserlerinin evreleri görülebilir:
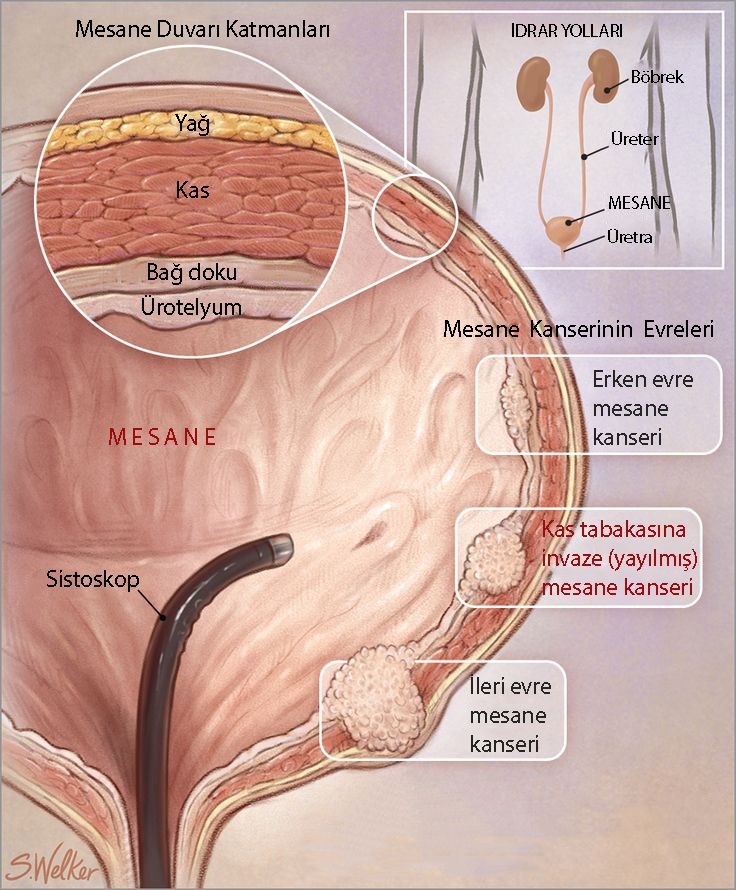
Yüksek riskli kasa-yayılmamış mesane kanserli hastaların tedavisi, karsinoma in situ (CIS) olanlar da dahil olmak üzere, genellikle TUR-M denilen tümörü kazıyarak çıkarmayı ve BCG kullanımını içerir. BCG-dirençli hastalar için etkili çok az tedavi seçeneği vardır.
İlgili konu: Yüksek riskli, BCG yanıtsız, kas tabakasına yayılmamış mesane kanserinde immünoterapi FDA onayı aldı
Bu durumdaki hastalar tedavi edilmediğinde, kanser kas tabakasına ve oradan lenf nodlarına ve diğer doku/organlara yayılabilir. ABD'de her yıl yaklaşık 57 bin erkek ve 18 bin kadın mesane kanseri tanısı alıyor ve yaklaşık 12 bin erkek ve 4,7 bin kadın bu hastalığa bağlı yaşamını kaybediyor. 2020 Türkiye Kanser İstatistikleri'ne göre ülkemizde 1 yılda ortaya çıkan yeni mesane kanserli hasta sayısı 12,2 bin iken, bu hastalığa bağlı yıllık yaşam kaybı sayısı 3,7 bin olarak raporlandı.
Nadofaragene firadenovec-vncg Etki Mekanizması Nasıldır?
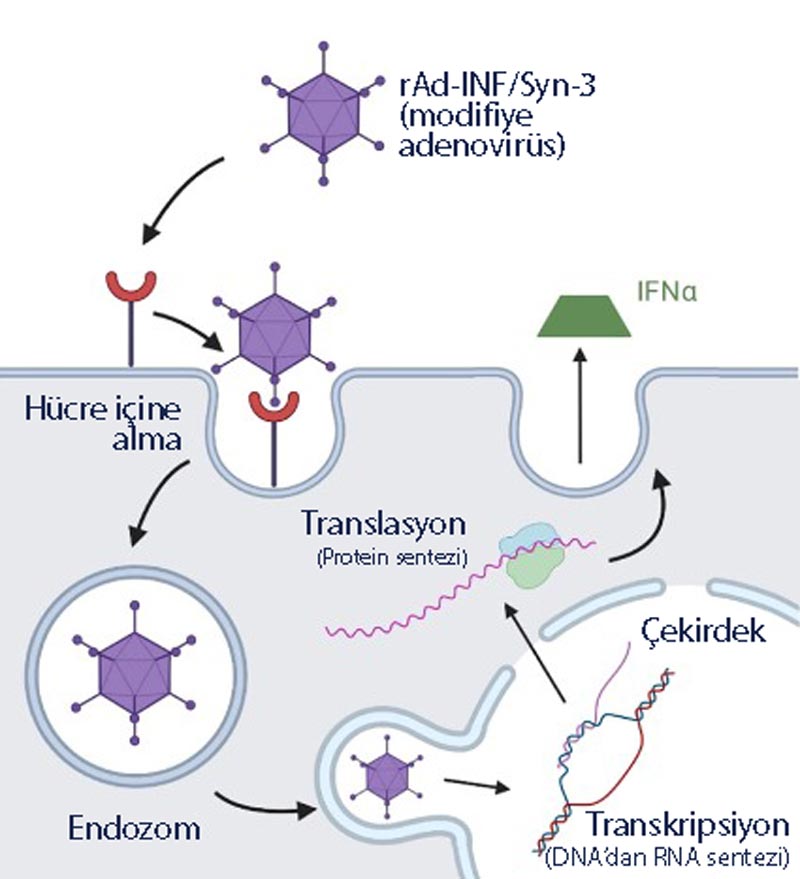
Etken molekül ismi nadofaragene firadenovec-vncg olan Adstiladrin, interferon alfa-2b genini içeren ve insan vücudunda çoğalmayan adenovirus vektörü tabanlı bir gen terapisidir. Modifiye edilmiş adenovirüs, mesanenin iç tabakasındaki hücrelere girer ve aktif geni salar. Bu geni alan hücreler yüksek miktarlarda interferon alfa-2b proteinini salgılar. İnterferon doğal olarak vücutta kanserle bağışıklık sisteminin savaşması için kullanılan bir proteindir. Bu yenilikçi gen terapisi yöntemiyle, hastanın kendi mesane duvar hücreleri interferon mikrofabrikalarına dönüşür ve bağışıklık sisteminin kansere karşı tepkisi artırılır. Bu haliyle Adstiladrin, bir çeşit immünoterapi de sayılır.
Aşağıda, Adstiladrin etki mekanizması resmedilmiştir:
Nadofaragene firadenovec-vncg'ye FDA Onayı Getiren Çalışma
Adstiladrin'in güvenliliği ve etkililiği, yüksek riskli BCG'ye yanıt vermeyen kasa-yayılmamış mesane kanserine sahip 157 hastayı içeren çok merkezli bir klinik çalışmada değerlendirildi; bunların 98'i, papiller tümörleri olan veya olmayan BCG'ye yanıt vermeyen karsinoma in situya sahipti.
Hastalar, 12 aya kadar, kabul edilemez yan etkiye veya kanser tekrarına kadar her üç ayda bir Adstiladrin aldı.
- Genel olarak, Adstiladrin tedavisi kullanan kayıtlı hastaların %51'i tam bir yanıt elde etti.
Tam yanıt, sistoskopi, biyopsi alınan doku ve idrarda tüm kanser belirtilerinin kaybolması olarak tanımlandı.
- Ortanca yanıt süresi 9.7 aydı. Yanıt veren hastaların %46'sı en az bir yıl boyunca tam yanıtta kaldı.
Adstiladrin, her üç ayda bir idrar sondası yoluyla mesaneye verilir. Adstiladrin ile ilişkili en yaygın yan etkiler arasında mesane akıntısı, yorgunluk, mesane spazmı, acil idrar çıkma ihtiyacı, hematüri (idrarda kan varlığı), titreme, ateş ve ağrılı idrara çıkma yer alır. Bir hasta için Adstiladrin tedavisinin ABD'de 1 yıllık maliyeti yaklaşık 200 bin Dolar olarak açıklanmıştır. Bağışıklığı baskılanmış veya bağışıklığı yetersiz olan kişilere Adstiladrin uygulanmamalıdır.
FDA Approves First Gene Therapy for the Treatment of High-Risk, Non-Muscle-Invasive Bladder Cancer. 16 December 2022. fda.gov






