Gen Düzenleme Çağı Resmen Başladı – Tıpta Yeni Dönem
Son zamanlarda ABD ve Birleşik Krallık'ta, exagamglogene autotemcel (exa-cel [Casgevy, Vertex Pharmaceuticals/CRISPR Therapeutics]) adlı tedavinin orak hücre hastalığı (OHH) ve transfüzyon bağımlı β-talasemi tedavisi için onaylanması, tıpta gen düzenlemenin yeni bir çağının başlangıcını işaret ediyor.
Sadece Birkaç Yılda Laboratuvardan Klinik Pratiğe
Bu önemli gelişme, bakteriyel bir bağışıklık sistemi olan clustered regularly interspaced short palindromic repeats (CRISPR) – Cas9'un programlanabilir bir gen düzenleme nükleazına dönüştürülmesini anlatan ilk bilimsel raporun yayımlanmasından yalnızca biraz fazla bir süre sonra ve bu makalenin iki kıdemli yazarı Jennifer Doudna ve Emmanuel Charpentier'in Nobel Kimya Ödülü'nü paylaşmasından sadece 3 yıl sonra gerçekleşti. Bu hızlı genetik tıp dönüşümü, laboratuvar araştırmalarının klinik uygulamalara hızla entegre edilmesi ve bu klinik deneyimlerin yeni araştırmaları beslemesi sayesinde, akademik tıbbın sürekli olarak ilerlemesini sağlayan dinamik bir süreci temsil etmektedir. Ancak, exa-cel, hastalığa bağlı genetik mutasyonları doğrudan düzenleyen ve onaran vaat edilen tedaviler dalgasının ilki olsa da, dünya çapında OHH hastası milyonlarca kişinin en ağır hastalarının bile bu potansiyel iyileştirici tedaviye erişimini sağlamak için hala önemli zorlukların üstesinden gelinmesi gerekmektedir.
Linus Pauling: "İlk Moleküler Hastalık"
1949 yılında, Linus Pauling, normal ve orak hücre hastalığı ile ilişkili hemoglobin arasındaki farkı detaylandırdığı bir makalede orak hücre anemisini "ilk moleküler hastalık" olarak adlandırdı. Artık OHH'nin en yaygın türünün, yetişkin hemoglobininde (HbS) altıncı pozisyonda tek bir amino asit değişimine (glutamik asit yerine valin) neden olan tek bir nokta mutasyonuna (GAG'dan GTG'ye) bağlı olduğunu biliyoruz. Bu durumu taşıyan kişilerde, kırmızı kan hücreleri şeklini değiştirir ve bu da dokulara yeterince oksijen gitmemesine, şiddetli ağrılara ve oksijen yetersizliğine neden olur. OHH taşıyıcılarında bu ağrı krizleri, genellikle bebeklerde yaklaşık 6 aylıkken, fetal dönemde oksijeni daha iyi taşıyan hemoglobinin (HbF) yerini yetişkinlerde görülen hemoglobine (HbS) bırakmasıyla başlar.
Tek Mutasyon, Farklı Sonuçlar
3 milyar baz çiftinden oluşan insan genomunda sadece tek bir nokta mutasyonu, her iki ebeveynden de alındığında, OHH'ye neden olmak için yeterlidir, ancak doktorlar uzun zamandır hastalığın şiddetinde büyük farklılıklar gözlemlemişlerdir, bu da genomun diğer bölgelerindeki mutasyonların OHH'yi değiştirdiğini düşündürmektedir. Özellikle, OHH'de ağrı krizlerini ve hastalıkla ilgili sağlık sorunlarını azaltan nadir bir durum olan kalıtsal fetal hemoglobin persistansı (HPFH) vardır. Bu durum, fetal hemoglobin seviyelerini yüksek tutar. Bu gözlem, bilim insanlarına ve doktorlara şu fikri verdi: Eğer kırmızı kan hücreleri tekrar fetal hemoglobin üretmeye yönlendirilirse, HPFH'nin faydaları taklit edilebilir ve OHH belirtileri büyük ölçüde hafifletilebilir.
Exa-cel, CRISPR-Cas9'un İlk Ayak Sesleri
Bakteriyel adaptif bağışıklığın merak odaklı çalışmaları, CRISPR-Cas9'un keşfine yol açarken, exa-cel'in gen düzenlemedeki başarısı da globin gen düzenlemesine ilişkin temel çalışmalara dayanmaktadır. Son yirmi yılda, Boston Çocuk Hastanesi ve Harvard Tıp Okulu'ndaki Orkin ve meslektaşları, birçok iş birliği ile birlikte, globin değişiminin temel moleküler mekanizmalarını ortaya çıkarmış ve şimdi exa-cel olarak onaylanan CRISPR-Cas9 gen düzenlemesinin genomik hedefini belirlemişlerdir.
HbF'nin yeniden aktivasyonu için moleküler hedefin keşfi, modern genomik, özellikle HbF seviyelerini belirleyen genetik varyasyonların kromozomal konumlarının haritalanması için genom çapında ilişkilendirme çalışmalarının uygulanmasına dayanmaktadır.
Bilimsel bir dedektiflik başarısında, Thein, Cao, Orkin ve meslektaşları, HbF seviyeleri yüksek ve OHH ağrı kriz oranları düşük olan bir gen olan BCL11A çevresinde bir genomik ilgi bölgesi belirlediler. Sankaran ve Orkin'in sonraki moleküler çalışmaları, BCL11A'nın olgun yetişkin kırmızı kan hücrelerinde gen transkripsiyonunu susturan bir baskılayıcı protein olduğunu kesin olarak ortaya koydu. Potansiyel bir tedavi için bir kanıt olarak, Orkin grubu, OHH'nin fare modelinde BCL11A'nın silinmesinin, patolojik hemolitik anemiyi normale döndürdüğünü, kırmızı hücre sayılarını ve hemoglobin seviyelerini yeniden kazandırdığını ve kırmızı hücrelerin oraklanmasını ortadan kaldırdığını gösterdi. Daha sonra, Bauer ve Orkin grupları, BCL11A'nın transkripsiyonel kontrol bölgelerini CRISPR-Cas9 kullanarak kapsamlı bir şekilde mutasyonlayarak, HPFH'yi taklit etmek ve böylece HbF ifadesini yeniden sağlamak için CRISPR-Cas9 ile hedeflenecek kesin yerleri belirlediler.
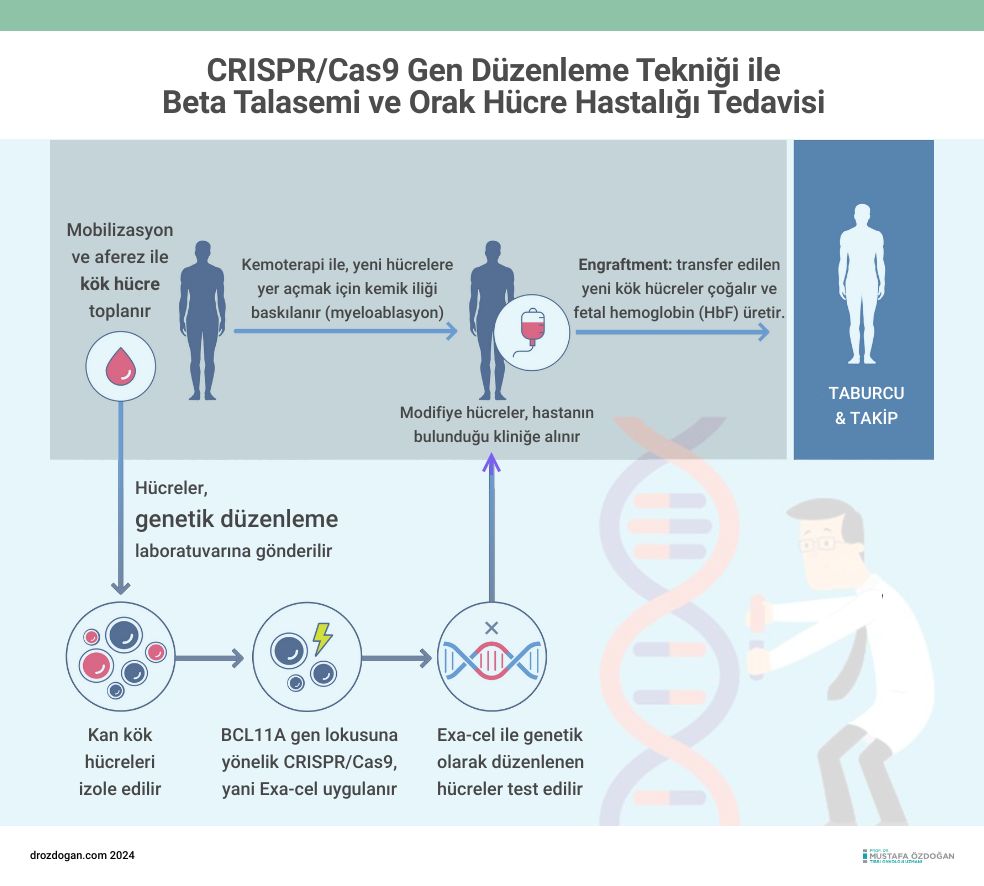
CRISPR Therapeutics ve Vertex Pharmaceuticals tarafından izlenen strateji, bu çalışmaların belirlediği bir hedefi kullandı: BCL11A ifadesini kontrol eden eritroid spesifik arttırıcı. 2021'de, OHH'li bir hasta ve transfüzyon bağımlı β-talasemili bir hastadan klinik veriler bildirildi ve hipotez doğrulandı: BCL11A ifadesini kapatmak için CRISPR-Cas9 düzenlemesi, HbF ifadesinde artışa ve OHH'li hastada ağrı krizlerinin ve β-talasemili hastada transfüzyon bağımlılığının ortadan kalkmasına yol açtı. Sonraki 2 yıl içinde, tedavi edilen 30 OHH hastasının 29'u en az 12 ay boyunca vaso-oklüzif krizlerden uzak kaldı. Benzer şekilde, Locatelli ve arkadaşlarının şimdi Journal'da bildirdiği gibi, 35 β-talasemili hastanın 32'sinde transfüzyon bağımsızlığı sağlanmıştır. Bu etkileyici sonuçlar, exa-cel'in her iki durum için de düzenleyici onayını haklı çıkardı. Off-target düzenlemenin analizi rahatlatıcı olmuştur, ancak gen düzenleme prosedürlerinin güvenliğini sağlamak ve bu tedavinin OHH'nin neden olduğu sayısız organ yaralanmasını önleyip önlemediğini belirlemek için uzun vadeli takip çalışmaları gereklidir.
Globin Gen Değişimi ve Exa-cel'in Fetal Hemoglobin İfadesinin Yeniden Aktivasyonu İçin Şema

Şema Açıklaması: Hemoglobin, kromozom 16 üzerindeki bir gen kümesinden ifade edilen iki alfa (α) alt birim ve embriyonik (ε), fetal (γ) ve yetişkin (β) genlerinden oluşan bir β-globin gen kümesinden iki alt birim içeren bir tetramerdir.
- Panel A: Fetal Hemoglobin
- Fetal gelişimin büyük bir kısmında, γ geni baskın olarak ifade edilir.
- Panel B: Globin Değişimi
- BCL11A geni (kromozom 2'de yer alır) ekspresyonu, iki γ-globin geninin ekspresyonunu azaltır ve β-globin ekspresyonunun artışına yol açar.
- Eğer β alt birimi HbS mutasyonunu taşırsa, anormal hemoglobin polimerizasyona eğilimlidir ve kırmızı hücrelerin patolojik şekilde oraklanmasına neden olur.
- Panel C: HbS Mutasyonu
- Anormal HbS miktarı polimerizasyon eşiğinin altında kalır.
- Exa-cel, BCL11A içindeki bir güçlendiriciyi kesip bozan bir kılavuz RNA yönlendirmeli CRISPR-Cas9 kompleksini kullanır.
- Bu güçlendirici, eritroid soy içinde BCL11A ifadesi için kritik öneme sahiptir.
- BCL11A baskısının kaldırılması, γ-globin gen ifadesini yeniden aktif hale getirir, bu da anormal HbS'nin yerine geçer ve onu kırmızı hücrelerde polimerizasyon eşiğinin altına seyreltir, böylece oraklanmayı ortadan kaldırır.
Detaylarda Gizli Kalanlar
Bu başarı kutlama sebebi olsa da, zorluklar devam etmektedir. Exa-cel, otolog kemik iliği nakli bağlamında gen düzenlemesi gerektirmektedir; bu, kök hücre toplanması, ex vivo gen aktarımı ve tüm ABD hastanelerinin yönetemeyeceği, özel yoğun bakım seviyesinde bir nakil prosedürü içermektedir.
Transplantasyon merkezleri, milyonlarca insanın OHH'ye sahip olduğu Sahra Altı Afrika da dahil olmak üzere, düşük kaynaklı bölgelerde nadirdir. Ayrıca, exa-cel son derece maliyetlidir ve tedavi başına 2.2 milyon dolar olarak fiyatlandırılmıştır. Tek bir tedavi işlevsel bir tedavi sağlayabilirken, kısırlık riski taşıyarak geniş kabul için ek bir engel teşkil eder. 2023 Mart ayında düzenlenen Üçüncü Uluslararası İnsan Genomu Düzenleme Zirvesi'nin organizasyon komitesinin bildirisi, bu potansiyel iyileştirici genetik tedavilere eşit erişim sağlama zorunluluğunu ve tedaviyi demokratikleştirme yaklaşımları üzerine devam eden araştırmaları vurgulamıştır.
İlaçlar, gen terapilerinden daha ölçeklenebilir. Yakın zamanda onaylanan bileşik voxelotor (Oxbryta, Pfizer) bir anti-sickling tedavi olarak OHH için onaylanmıştır, ancak bir tedavi değildir. HbF ifadesini indükleyebilecek bir hap geliştirilmesi yüksek önceliğe sahiptir. CRISPR tabanlı gen düzenleme tekniklerindeki daha fazla yenilik, HbS mutasyonunu yeniden yazabilecek baz düzenleme ve primer düzenleme gibi teknikleri içermektedir. Primer düzenleme, mutasyonlu bazı sağlıklı insanların taşıdığı baz ile değiştirebilir.
Eşit ve Erişilebilr Bir Gelecek
Son olarak, daha erişilebilir ve maliyet etkin bir tedavi yöntemi, otolog ilik toplama, laboratuvar ortamında gen düzenleme ve kemik iliği nakli ihtiyacını ortadan kaldırabilir. Bunun yerine, hedeflenen kök hücrelerin gen düzenlemesi, CRISPR teknolojisini içeren çok küçük gen onarım makineleri ile doğrudan damar içi veya kas içi enjeksiyonlarla yapılabilir. Aşıya benzer, tek seferlik basit bir tedavi yöntemi, genetik tıbbın en büyük hedeflerinden biridir ve bu, küresel sağlıkta eşitliği artıracaktır. Teknolojideki hızlı ilerleme ve son başarılar göz önüne alındığında, bu gen düzenleme yöntemlerinin laboratuvardan klinik uygulamalara geçeceğine ve sonunda herkes için erişilebilir bir tedavi haline geleceğine inanıyorum.
Gen Düzenleme Alternatifleri de Çoğalıyor
Exa-cel, gen düzenlemeye dayalı ilk onaylanan ilaç olarak, tedavi görme şansı olan hastaları derinden etkileyecektir. Exa-cel, şu anda mevcut olan birçok potansiyel iyileştirici tedaviden sadece biridir. HLA uyumlu kardeşten kemik iliği nakli, bakım standardı olarak kalmaya devam ederken, haploidentik donörler kullanarak yeni transplantasyon protokolleri etkileyici sonuçlar göstermektedir. β-globin'in lentiviral vektör replasmanı (lovotibeglogene autotemcel [Lyfgenia, Bluebird Bio]), exa-cel ile aynı gün onaylanmıştır. Bu tedaviler arasında seçim yapmak zor olacaktır, çünkü en güvenli ve en etkili yaklaşım henüz tam olarak tanımlanmamıştır. Hem temel hem de klinik translasyonel araştırmaların zorlu çalışmaları devam etmelidir.
Gen düzenleme yöntemlerinin damar içi veya kas içi enjeksiyonlarla etkin bir şekilde vücuda verilmesi, gen düzenlemenin herkes için eşit ve erişilebilir bir tedavi seçeneği olmasını sağlamayı hedeflemektedir. Cure Sickle Cell Initiative tarafından 2018 yılında başlatılan ve Bill ve Melinda Gates Vakfı'ndan ortak fon sağlanan bir girişim olan bu hedef, NEJM'de yayımlanan bir editoryal yazıda McCune ve Kiem tarafından öncelikli olarak tanımlanmıştır. Kemik iliği kök hücrelerini hedefleyen primer düzenleme yönteminin damar içi enjeksiyonla uygulanabilirliği, OHH fare modelinde kanıtlanmıştır. Ancak, bu yöntemin klinik çalışmalara geçmeden önce daha da geliştirilmesi gerekmektedir. Teknolojik yeniliklerin hızı ve son başarıların getirdiği ivme göz önüne alındığında, gen düzenleme tekniklerinin etkili bir şekilde vücuda verilmesinin laboratuvardan klinik uygulamalara geçiş yapmasının kaçınılmaz olduğunu ve bu sayede gen düzenlemenin eşit ve erişilebilir bir tedavi yöntemi haline geleceğini düşünüyorum.
Daley GQ. Welcoming the Era of Gene Editing in Medicine. N Engl J Med. 2024 May 9;390(18):1642-1645. doi: 10.1056/NEJMp2314279. Epub 2024 Apr 24. PMID: 38657270.