
BRAF Mutasyonlu Kanserler için Dabrafenib-Trametinib Kombinasyonu FDA Onayı Aldı
BRAF V600E mutasyonu pozitif, ameliyatla çıkarılamayan veya 4. evre solid (organ) tümörleri olan yetişkin ve ≥ 6 yaş pediatrik hastaların tedavisi için trametinib (Mekinist, Novartis) ile kombinasyon halinde dabrafenibe (Tafinlar, Novartis) 22 Haziran 2022'de FDA (ABD Gıda ve İlaç İdaresi) hızlandırılmış onay verdi.
Bu kombinasyonun kullanılabilme şartı, hastanın daha önce tedavi almış olması ve tatmin edici alternatif tedavi seçenekleri olmaması olarak belirlendi. BRAF V600E mutasyonlu kolorektal tümörlü hastalar bu onayın dışında tutulmuştur, çünkü BRAF baskılamaya karşı dirence sahiptirler.
Böylelikle BRAF, kanserin kaynaklandığı organdan bağımsız olarak FDA onayına konu olan 4. pan-kanser tümör biyobelirteci oldu. Daha önce MSI, TMB ve NTRK moleküler hedeflerine bu şekilde onay verilmişti.
BRAF Geni ve Mutasyonu Nedir?
BRAF geni, mitogen-aktivated protein kinaz hücre içi sinyal yolunda (MAPKs) rol alan serin / treonin kinaz aktivitesine sahip bir proteini kodlar. Etkisini Kras üzerinden gerçekleştirerek hücre bölünmesini kontrol eder. En sık olarak cilt kanseri malign melanomda, kolorektal kanserlerde, papiller tirod kanserinde somatik BRAF gen mutasyonları saptanmaktadır. Hastalarda en sık V600E mutasyonu gözlenir.
BRAF mutasyonuna sahip hastalarda genel olarak hastalığın daha agresif seyrettiği bilinmekle birlikte, V600-dışı BRAF mutasyonuna sahip 4. evre kolon ve rektum kanserinde hastalık gidişatının (prognoz) çok daha iyi olduğuna dair çalışmalar mevcuttur. Bu nedenle, sadece bu mutasyonun pozitifliğine bakılarak yorum yapılmamalı, mutasyonun hangi kodonda yer aldığı da dikkate alınmalıdır.
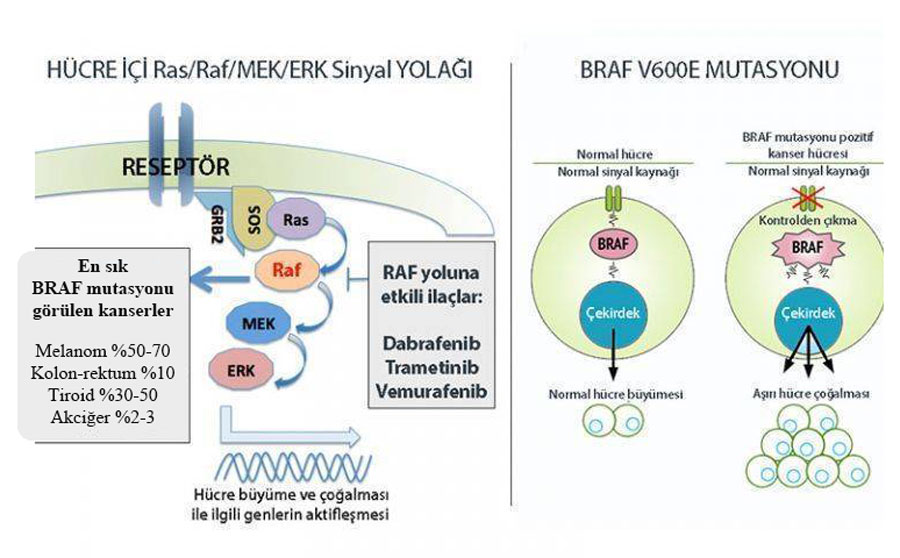
FDA Onayına Konu Olan Çalışmalar
Toplam 131 yetişkin ve 36 pediyatrik hastanın sonuçlarının değerlendirildiği farklı çalışmalar sonucunda trametinib-dabrafenib kombinasyonuna bu durumdaki hastalar için FDA onayı verildi.
Hastalar yüksek dereceli glioma (YDG), safra yolu kanseri, düşük dereceli glioma (DDG), ince bağırsak adenokarsinomu, gastrointestinal stromal tümör ve anaplastik tiroid kanseri dahil BRAF V600E mutasyon pozitif solid tümörlere sahipti. Pediatrik hastalar yüksek ve düşük dereceli glioma sahip 36 hasta idi.
Çalışmalar, farklı YDG ve DDG alt tipleri dahil olmak üzere 24 tümör tipine sahip hastaları kaydetti.
Bu çalışmaların ana etkililik sonuç ölçüsü, genel yanıt oranıdır.
Sonuçlar
- 131 yetişkin hastanın 54'ü (%41) objektif bir yanıt yaşadı.
- Çalışmada en sık temsil edilen tümör tipleri arasında objektif yanıt oranı;
- safra yolu kanseri için %46,
- yüksek dereceli glioma için %33, ve
- düşük dereceli glioma için %50 idi.
- 36 pediyatrik hasta için objektif yanıt oranı %25 (%95 GA: 12, 42) idi.
- Yanıtın süresi, hastaların %78'i için ≥6 ay ve hastaların %44'ü için ≥24 ay idi.
Yetişkin hastalarda en yaygın (≥%20) advers reaksiyonlar ateş, yorgunluk, bulantı, döküntü, titreme, baş ağrısı, kanama, öksürük, kusma, kabızlık, ishal, kas ağrısı, artralji (eklem ağrısı) ve ödemdir.
Pediyatrik hastalarda en yaygın (≥%20) advers reaksiyonlar ateş, döküntü, kusma, yorgunluk, kuru cilt, öksürük, ishal, akneiform dermatit, baş ağrısı, karın ağrısı, bulantı, kanama, kabızlık ve paronişidir (dolama).
Yetişkin hastalarda önerilen dabrafenib dozu günde iki kez oral yoldan 150 mg'dır (iki adet 75 mg kapsül), trametinib dozu günde bir kez oral yoldan 2 mg'dır. Pediyatrik hastalarda dabrafenib ve trametinib için önerilen dozlar vücut ağırlığına dayanmaktadır. 26 kg'ın altındaki hastalarda önerilen bir doz belirlenmemiştir.
FDA grants accelerated approval to dabrafenib in combination with trametinib for unresectable or metastatic solid tumors with BRAF V600E mutation / fda.gov / 22 June 2022






