Organdan Bağımsız Kanser Tedavilerinin Yükselişi – HER2 Pozitif Tüm Tümörler için Enhertu
Tümör agnostik yaklaşımlar, kanserin köken aldığı doku ya da organı göz ardı ederek, tümörün genetik özelliklerini hedef alan tedaviler olarak tanımlanır. Tümör agnostik yaklaşımlar, onkoloji alanında devrim niteliğinde bir gelişme olarak kabul edilmektedir. Geleneksel kanser tedavileri genellikle kanserin tipine ve kökenine odaklanırken, tümör agnostik tedaviler, kanserin yerine genetik özelliklerini hedef alır. Bu strateji, belli biyolojik belirteçlere sahip olan tümörleri, onların vücuttaki konumlarından bağımsız olarak tedavi etmeyi amaçlar.
İlk tümör agnostik onayı 2017'de, yüksek mikrosatellit instabilitesi (MSI-H) veya eşleşmeyen tamir eksikliği (dMMR) gösteren tümörler için pembrolizumab (Keytruda) ile başlamıştır. O zamandan beri, bu alanda önemli ilerlemeler kaydedilmiştir.
Günümüzde,
- MSI-H/dMMR,
- NTRK gen füzyonları,
- Yüksek tümör mutasyon yükü (TMB-H),
- BRAF mutasyonları ve
- RET füzyonları gibi çeşitli biyobelirteçler için FDA (ABD Gıda ve İlaç İdaresi) onayı almış 5 farklı tümör agnostik tedavi yaklaşımı bulunmaktadır.
HER2 pozitif tümörler için trastuzumab deruxtecan etken maddeli Enhertu ilacı da 6. tümör agnostik tedavi adayıdır.
Trastuzumab Deruxtecan Etki mekanizması Nasıldır?
Enhertu, bilimsel adıyla trastuzumab deruxtecan, bir antikor ilaç konjügatıdır (ADC= antibody drug conjugates). Bu ilacın etki mekanizması, iki önemli bileşeni birleştirerek çalışır: Bir antikor ve bir kemoterapi ilacı. Antikor, HER2 proteinini yüksek oranda ifade eden kanser hücrelerine özgüdür ve bu hücrelere hedeflenmiş bir şekilde bağlanır. Bu bağlanma, ilacın doğrudan kanser hücrelerine yönlendirilmesini sağlar.
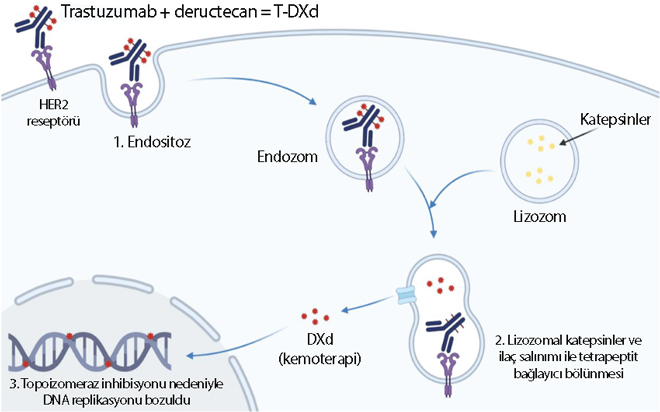
Enhertu'nun içerdiği kemoterapi ilacı, topoisomerase inhibitörüdür. Antikor, Enhertu'yu HER2'yi yüksek oranda ifade eden kanser hücrelerine taşıdığında, kemoterapi ilacı hücre içine salınır. Bu ilaç, kanser hücrelerinin DNA'sına zarar vererek onların büyümesini ve çoğalmasını engeller. Ayrıca, bu ilaç hücre ölümüne yol açarak tümörün küçülmesine veya yavaşlamasına neden olabilir.
Bu tedaviler, kanser tedavisinde kişiselleştirilmiş yaklaşımların önemli bir parçası haline gelmiştir.
Enhertu için Metastatik HER2+ Solid Tümörlerde Öncelikli FDA İnceleme Kararı
FDA, daha önce tedavi görmüş veya tatmin edici alternatif tedavi seçenekleri olmayan, opere edilemeyen veya metastatik HER2-pozitif (immünohistokimya [IHK] 3+) solid tümörleri olan yetişkinler için trastuzumab deruxtecanın kullanımına yönelik ek biyolojik ürün lisans başvurusunu öncelikli inceleme için kabul etti.
Trastuzumab deruxtecan, meme kanseri, küçük hücreli olmayan akciğer kanseri ve mide veya gastroözofageal bileşke adenokarsinomunun tedavisinde kullanılan, HER2'ye yönelik bir antikor ve topoisomeraz inhibitörü konjügatıdır ve şu anda Enhertu markası altında pazarlanmaktadır.
DESTINY-PanTumor02 Çalışması
Trastuzumab deruxtecanın bu yeni FDA başvurusu, devam eden faz 2 DESTINY-PanTumor02 çalışmasından elde edilen verilerle desteklenmektedir. Bu çalışma, seçilen HER2 pozitif tümörlerde trastuzumab deruxtecanın etkinliğini değerlendirmek üzere tasarlanmıştır.
Çalışmanın birincil analizi, ürotelyal kanser, safra yolu kanseri, serviks kanseri, endometriyal kanser, over kanseri, pankreas kanseri ve diğer kanserlerden oluşan 267 hastayı içermektedir.
Çalışmanın birincil son noktası doğrulanmış objektif yanıt oranıdır.
- Ortanca 12.75 aylık takip süresinde, objektif yanıt oranı %37.1 ve ortanca yanıt süresi 11.3 ay olarak belirlenmiştir.
- Ortanca ilerlemesiz sağkalım (PFS) 6.9 ay ve
- Ortanca genel sağkalım 13.4 aydır.
- HER2 ifadesi kuvvetli pozitif (3+) olan 75 hasta arasında,
- objektif yanıt oranı %61.3,
- ortanca yanıt süresi 22.1 ay,
- ortanca PFS 11.9 ay ve
- ortanca genel sağkalım 21.1 aydır.
Enhertu'nun üreticisi Japon Daiichi Sankyo'nun küresel Ar-Ge başkanı Dr. Ken Takeshita, "DESTINY-PanTumor02 çalışmasında ve Enhertu'nun klinik gelişim programından elde edilen süregelen veriler, bu ilacın onaylanmış endikasyonlarının ötesindeki potansiyelini göstermeye devam ediyor. Onaylanırsa, Enhertu tümör agnostik bir endikasyona sahip ilk HER2 hedefli tedavi ve antikor ilaç konjügatı olabilir, hastalara potansiyel olarak yeni bir tedavi seçeneği sunar," dedi. Ve FDA onay hedefinini 2024'ün ikinci çeyreği olduğunu belirtti.
1. Enhertu® (fam-trastuzumab deruxtecan-nxki) granted priority review in the US for patients with metastatic HER2-positive solid tumors. News release. AstraZeneca and Daiichi Sankyo. January 29, 2024. https://www.businesswire.com/news/home/20240129083517/en/ENHERTU%C2%AE-fam-trastuzumab-deruxtecan-nxki-granted-Priority-Review-in-the-US-for-patients-with-metastatic-HER2-positive-solid-tumors.
2. Meric-Bernstam F, Makker V, Oaknin A, et al. Efficacy and safety of trastuzumab deruxtecan in patients with HER2-expressing solid tumors: primary results from the DESTINY-PanTumor02 phase II trial. Journal of Clinical Oncology. Published online October 23, 2023. doi:10.1200/JCO.23.02005