
RET-pozitif Tüm Kanserler için Selpercatinib FDA Onayı Aldı
Sistemik tedavi sırasında veya sonrasında ilerleyen veya iyi bir alternatif tedavisi olmayan, bölgesel olarak ilerlemiş veya metastatik RET füzyon pozitif solid (organ/doku kaynaklı) tümörleri olan yetişkinler için selpercatinib (Retevmo, Eli Lilly and Company) adlı ilaç, 21 Eylül 2022’de hızlandırılmış FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
2020'de selpercatinib, RET-pozitif akciğer ve tiroid kanserleri için hızlandırılmış FDA onayı almıştı; bu onay, 21 Eylül'de küçük hücreli olmayan akciğer kanseri için düzenli bir onaya geçti. En son onay, ilacın kullanımını pankreas ve kolorektal kanserler dahil olmak üzere bir dizi RET-pozitif tümör türünü içerecek şekilde genişletiyor.
RET Füzyonu Nedir?
RET geni, bir proto-onkogendir ve hücre içi sinyalleşmede yer alan bir proteinin üretilmesi için talimatlar sağlar. Bu protein, bağırsaktaki sinirler ve sinir sisteminin kalp hızı gibi istemsiz vücut fonksiyonlarını kontrol eden kısmı (otonom sinir sistemi) dahil olmak üzere çeşitli sinir hücrelerinin normal gelişimi için gerekli görünmektedir. RET proteini ayrıca normal böbrek gelişimi ve sperm üretimi (spermatogenez) için de gereklidir. RET geninin fonksiyonlarının kaybolmasına denen olan mutasyonlar, Hirschsprung hastalığının gelişimi ile ilişkilidir; buna karşılık gene farklı fonksiyonlar kazandıran mutasyonlar ise çeşitli insan kanseri türlerinin gelişimi ile ilişkilidir. RET füzyonu da bu genetik değişimlerden biridir. RET geni değişimleri, akciğer kanseri hastalarının yaklaşık %1-2'sinde görülür. Sonuç olarak RET füzyonu, çeşitli kanser türlerinde nadir görülen kanser tetikleyici bir genetik değişimdir.
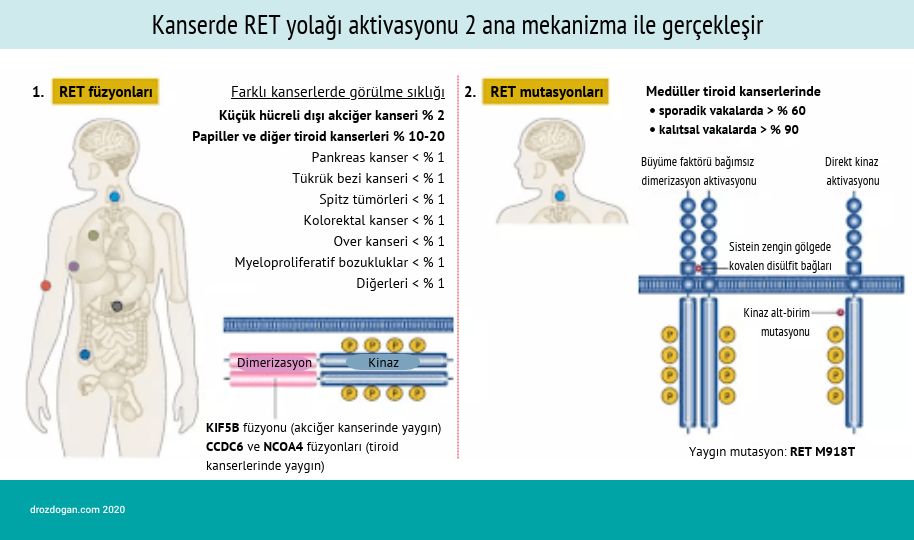
RET Füzyonu, Pan-kanser Biyobelirteçler İçinde Yerini Aldı
Kanserlerin, kaynaklandığı organ/dokudan bağımsız bir şekilde tedavi edildiği örnekler, her geçen gün artıyor. Bu onayla birlikte RET-füzyonunun, organdan bağımsız bir şekilde tedaviyi yönlendiren genetik biyobelirteçlerden biri haline geldiği doğrulandı.
Onay, RET füzyon pozitif tümörleri olan 41 hastayı değerlendiren faz 1/2 LIBRETTO-001 çalışmasından elde edilen verilere dayanıyordu. Otuz yedi hasta (%90) önceden sistemik tedavi almıştı ve neredeyse üçte biri üç veya daha basamak sistemik tedavi almıştı. Çalışmanın birinci etkinlik ölçütleri, genel yanıt oranı ve yanıt süresiydi.
41 hasta arasında toplam yanıt oranı %44 olup, bu hastalar için ortanca yanıt süresi 24,5 aydır. Ek olarak, hastaların %67'si için yanıtlar en az 6 ay sürmüştür.
Bu onay, tümör tipinden bağımsız tedavi seçeneklerinin arttığına vurgu yapmaktadır ve çok çeşitli tümör tiplerine sahip ileri evre hastalar için rutin, kapsamlı genomik testlerin önemini vurgulamaktadır.
Çalışmada en sık görülen kanserler pankreas adenokarsinomu (%27), kolorektal kanser (%24) ve tükürük bezi kanseri (%10) idi.
Selpercatinib ile ilişkili en yaygın yan etkiler ödem, ishal, yorgunluk, ağız kuruluğu, hipertansiyon, karın ağrısı, kabızlık, döküntü, mide bulantısı ve baş ağrısıydı.
Vücut ağırlığına dayalı olarak önerilen selpercatinib dozu, 50 kilo altındaki hastalar için oral olarak günde iki kez 120 mg veya 50 kilo ve üstündekiler için günde iki kez 160 mg'dır.
FDA approves selpercatinib for locally advanced or metastatic RET fusion-positive solid tumors. 21 Sep 2022 https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-selpercatinib-locally-advanced-or-metastatic-ret-fusion-positive-solid-tumors






