
Akciğer ve tiroid kanserlerinde görülebilen RET mutasyonuna yönelik İLK TEDAVİ FDA onayı aldı: Selpercatinib
8 Mayıs 2020'de, ABD Gıda ve İlaç İdaresi (FDA), tümörlerinde RET genetik değişimi (mutasyon veya füzyon) olan küçük hücreli dışı akciğer kanseri, medüller tiroid kanseri ve diğer tiroid kanseri türleri olmak üzere üç tip tümörün tedavisi için selpercatinib (Retevmo) kapsüllerine hızlandırılmış onay verdi. Selpercatinib, RET gen değişiklikleri olan kanser hastalarına özgü olarak onaylanan ilk tedavidir.
Kanseri tetikleyen ve kanserin yayılmasına sebep olan belli gen değişimlerini hedefleyen tedavilerdeki yenilikler - ki bunlara akıllı kanser ilaçları diyoruz - hızlı bir şekilde onkoloji pratiğine girmeye devam ediyor.
Selpercatinibin tedavi etmek için FDA onayı aldığı kanserler şunları içerir:
- İleri evre RET füzyonu pozitif küçük hücreli dışı akciğer kanseri (KHDAK),
- Sistemik tedaviye ihtiyaç duyan RET mutasyonu pozitif 12 yaş ve üstü ileri evre medüller tiroid kanseri, ve
- Radyoaktif iyot tedavisine yanıt vermeyen veya radyoaktif iyot tedavisi için uygun olmayan RET füzyonu pozitif sistemik tedavi gerektiren 12 yaş ve üzerindeki ileri RET füzyon-pozitif tiroid kanseri.
Selpercatinib bir kinaz inhibitörüdür, yani bir tür enzimi (kinaz) bloke eder ve kanser hücrelerinin büyümesini önlemeye yardımcı olur. Tedaviye başlamadan önce, bir RET gen değişikliği laboratuvar testi kullanılarak belirlenmelidir.
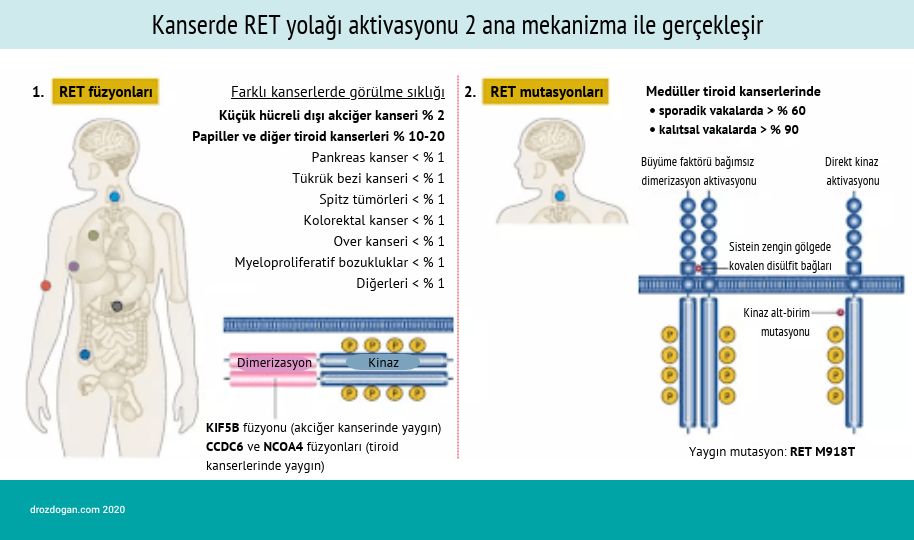
RET geni, bir proto-onkogendir ve bir tirozin kinaz hücre yüzey reseptörü olan RET reseptörünü kodlar. Bu genin hem işlev kaybı (örneğin Hirschsprung hastalığı) hem de aşırı/yanlış aktivasyonu (örneğin kanserler) çeşitli hastalıklara neden olur.
Aşağıda, RET genetik değişimlerinin çeşitleri ve bu 3 kanser türünde ve diğer kanserlerde sıklıkları görülebilir.
Selpercatinibe (Retevmo) FDA onayı getiren klinik çalışma: LIBRETTO-001
FDA, Retevmo'yu üç tip tümörden her birini içeren, faz I/II LIBRETTO-001 adlı klinik çalışmanın sonuçları ile onayladı. Klinik çalışma sırasında, hastalara hastalık ilerlemesi veya kabul edilemez yan etki oluncaya kadar günde iki kez 160 mg selpercatinib kapsül içirildi. Başlıca etkinlik sonuç ölçümleri, belirli bir miktarda tümör küçülmesine sahip hastaların yüzdesini ve yanıt süresini yansıtan genel yanıt oranı idi.
Daha önce platin-bazlı kemoterapi ile tedavi edilen RET füzyon-pozitif küçük hücre dışı akciğer kanserli (KHDAK) 105 yetişkin hastada selpercatinibin etkinliği değerlendirildi. 105 hasta için genel yanıt oranı % 64 idi. Tedaviye yanıt veren hastaların % 81'inde yanıtları en az 6 ay sürmüştür. Etkililik, daha önce hiç tedavi almamış olan RET füzyon-pozitif KHDAK'li 39 hastada da değerlendirildi. Bu hastalar için genel yanıt oranı % 84 idi. Tedaviye yanıtı olan hastaların % 58'i için yanıtlar en az altı ay sürmüştür.
Yetişkinlerde ve pediyatrik medüller tiroid kanserinde (MTK) selpercatinibin etkinliği, RET-mutant 12 yaş ve üstü hastalarda değerlendirildi. Çalışmada daha önce cabozantinib, vandetanib veya her ikisi ile tedavi edilmiş ileri evre veya metastatik RET-mutant MTK'sı olan 143 hasta ve cabozantinib veya vandetanib ile daha önce tedavi görmemiş ileri evre veya metastatik RET-mutant MTK'sı olan hastalar alındı. Daha önce tedavi alan 55 hasta için genel yanıt oranı % 69'du. Tedaviye cevap veren hastaların % 76'sında yanıtları en az 6 ay sürmüştür. Daha önce tedavi almamış 88 hasta için genel yanıt oranı % 73 idi. Bu hastalar içinde tedaviye yanıt verenlerin % 61'inde yanıtları en az 6 ay sürmüştür.
RET füzyon-pozitif tiroid kanseri için selpercatinibin etkinliği 12 yaş ve üstü erişkinlerde ve pediyatrik hastalarda değerlendirildi. Çalışmaya radyoaktif iyot (RAİ) tedavisine direnç gelişen ve daha önce başka bir sistemik tedavi uygulanan RET füzyon-pozitif tiroid kanseri olan 19 hasta ve daha önce başka bir sistemik tedavi uygulanmayan fakat radyoaktif iyot tedavisine direnç gelişen RET füzyon-pozitif tiroid kanseri olan 8 hasta kaydedildi. Daha önce tedavi edilen 19 hasta için genel yanıt oranı % 79 idi. Tedaviye yanıt veren hastaların % 87'sinde yanıtları en az 6 ay sürmüştür. RAİ dışında tedavi almayan 8 hastada genel yanıt oranı % 100 idi. Bu hastalar içinde tedaviye yanıt verenlerin % 75'inde yanıtları en az 6 ay sürmüştür.
Selpercatinib ile bildirilen en yaygın yan etkiler karaciğerde artmış aspartat aminotransferaz (AST) ve alanin aminotransferaz (ALT) enzimleri, artmış kan şekeri, azalmış beyaz kan hücresi sayısı, kanda albümin azalması, kanda kalsiyum azalması, ağız kuruluğu, ishal, artmış kreatinin (böbrek fonksiyonunu ölçer), artmış alkalin fosfataz (karaciğer ve kemiklerde bulunan bir enzim), hipertansiyon, yorgunluk, vücutta veya uzuvlarda şişme, düşük kan trombosit sayısı, artmış kolesterol, döküntü, kabızlık ve kanda azalmış sodyumdur.
Selpercatinib hepatotoksisite (karaciğer hasarı), yüksek kan basıncı, kal grafisi EKG'de QT uzaması (kalp kasının atımlar arasında şarj olması normalden daha uzun sürer), kanama ve alerjik reaksiyonlar gibi ciddi yan etkilere neden olabilir. Bir hastada hepatotoksisite görülürse, selpercatinib dozu azaltılmalı veya kalıcı olarak kesilmelidir. Selpercatinib grubu ilaçlar, yara iyileşmesinde ciddi gecikmelere sebep olabilir, bu nedenle ameliyat öncesi sonrası dikkatli planlanmalıdır.
Selpercatinib gelişmekte olan bir fetüse veya yeni doğmuş bir bebeğe zarar verebilir. Sağlık uzmanları hamile kadınlara bu risk konusunda tavsiyede bulunmalı ve hem üreme potansiyeli olan kadınlara hem de üreme potansiyeli olan kadın partnerleri olan erkeklere, selpercatinib ile tedavi sırasında ve son dozdan bir hafta sonra etkili doğum kontrol yöntemi kullanmalarını tavsiye etmelidir. Ayrıca, kadınlar selpercatinib kullanırken emzirmemelidir.
Selpercatinib (Retevmo), ciddi veya yaşamı tehdit eden hastalıkları tedavi eden ve genellikle mevcut tedavilere göre anlamlı bir avantaj sağlayan ilaçların onaylanmasını sağlayan FDA'nın "Hızlandırılmış Onay" yolu altında onaylanmıştır. Ek olarak, Retevmo, nadir hastalıklar için ilaçların geliştirilmesine yardımcı olmak ve teşvik etmek için teşvikler sağlayan "Yetim İlaç" tanımlamasını da almıştı.
*
FDA Approves First Therapy for Patients with Lung and Thyroid Cancers with a Certain Genetic Mutation or Fusion.
fda.gov - 08 May 2020.






