Amerikan Gıda ve İlaç Dairesi (FDA) tarafından kullanımına onay verilen yeni kanser ilaçları:
Hastalıkların tanısı, tedavisi ve hastalıklardan korunma için kullanılan ve bedenin fonksiyonu veya yapısını etkileyen ürünlere ilaç denir. Yeni kullanılmaya başlanacak herhangi ilaç, ciddi bir değerlendirme ve onay sürecinden geçmelidir. Yeni ilaçlar için her ülkenin kendine özgü onay, ruhsatlandırma ve geri ödeme mekanizmaları olmakla birlikte, bu konuda öncü kurum Amerikan Gıda ve İlaç İdaresi’dir.
İlaç onay süreçler: Faz çalışması nedir? Keşfedilen bir maddenin ilaca dönüşme süreci nasıldır?
Erken test: Potansiyel bir ilacın keşfinden sonra, ilacın canlı hücrelerle nasıl etkileştiğini ve ne kadar toksik olduğunu test etmek için yapılan laboratuvar çalışmalarıdır.
Hayvan testi: Laboratuvar çalışmaları sonrası umut vaat eden bir ilaç, ne kadar güvenli olduğunun test edilmesi amacıyla hayvan deneylerinde kullanılabilir. Bu sayede ilacın yan etkileri ve tedavi edici gücü hakkında da fikir edinilir.
Yeni ilaç araştırma uygulamaları: Laboratuvar ve hayvan çalışmaları umut vaat edici sonuçlar verirse, ilaç üreticisi firma FDA’ya yeni ilaç araştırma uygulamaları (klinik çalışmalar) için başvurur.
Klinik çalışmalar: eğer FDA yeni ilaç araştırma uygulamalarına onay verirse, insan katılımcılardan oluşan klinik çalışmalara başlanır. Klinik çalışmalar fazlara ayrılır:
Faz 1 çalışmalar, tipik olarak 100 kişiden daha az katılımcı vardır ve temel hedef ilaç güvenliğini test etmektir. Çoğunlukla katılımcılar sağlıklı gönüllülerden oluşur.
Faz 2 çalışmalar, yüzlerce katılımcı ile yapılan klinik çalışmalardır. Belli hastalıklar ve durumlar için ilacın en uygun dozu araştırılır. Çoğunlukla katılımcılar hastalardan oluşur.
Faz 3 çalışmalar, yüzlerce veya binlerce katılımcıdan oluşan çalışmalardır. İlacın güvenliği ve etkinliği test edilir. Bu çalışmalarda araştırılan ilaç, çoğunlukla plasebo adı verilen ilaç etkinliği olmayan ürünlerle veya araştırılan ilacın alanında daha önce onay almış diğer ilaçlarla karşılaştırılır.
Onay almış yeni ilaç uygulamaları: Klinik çalışmalar tamamlandıktan sonra, ilaç üreticisi firma yeni ilaç uygulaması için başvuruda bulunur. FDA standart yeni ilaçları 10 ay, çok önemli yeni ilaçları 6 ay boyunca yakın takibe alır. Sonuçta FDA ilaca onay verirse, ilacın prospektüsü hazırlanır ve piyasaya sürülür.
Satış sonrası takip: İlacın onaylanmasından sonra, prospektüs bilgileri çoğunlukla yan etkiler üzerinden güncellenebilir. İlaç üreticisi firma ilacın güvenlik güncellemeleri için başvuruda bulunabilir, ayrıca hekimler veya hastalar ilaçla ilgili ciddi yan etkileri bildirebilir.
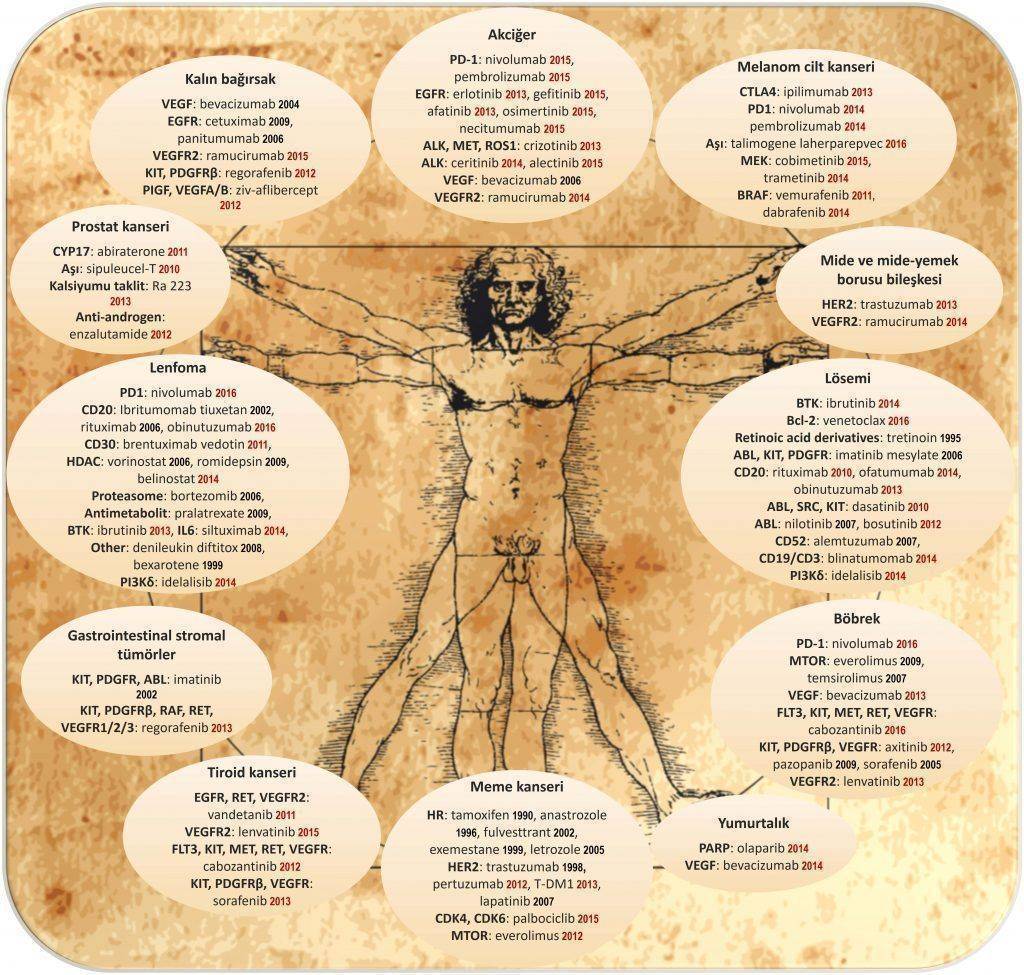
Amerika Gıda ve İlaç Dairesi (FDA) tarafından onaylı hedefe yönelik kanser ilaçlarını resimde bulabilirsiniz. Akıllı ilaçların birçoğunun 2010 ve sonrasında onay alması dikkat çekicidir. Bu durum, kanser tıbbındaki gelişmelerin giderek hız kazandığının başka bir göstergesidir. (Not: yeni ilaçlar için her ülkenin kendine özgü onay, ruhsatlandırma ve geri ödeme mekanizmaları olmakla birlikte, bu konuda Dünya genelinde öncü kurum FDA'dır)
Yeni bir ilacın geliştirilme süreçlerinden kısaca bahsettik. Şimdi gelin hep birlikte FDA tarafından kanser alanında kullanılmak üzere onay verilmiş önemli birkaç ilacı inceleyelim: