
EGFR Mutant Akciğer Kanserinde Osimertinib ve Kemoterapi FDA Onayı Aldı
16 Şubat 2024'te, ABD Gıda ve İlaç İdaresi (FDA), lokal ileri veya metastatik küçük hücreli dışı akciğer kanseri (KHDAK) olan ve tümörleri FDA onaylı bir test ile tespit edilen EGFR ekzon 19 silinmeleri veya ekzon 21 L858R mutasyonlarına sahip hastalar için platin bazlı kemoterapi ile osimertinib (Tagrisso, AstraZeneca) kombinasyonuna birinci basamak tedavi olarak onay verdi.
Akciğer kanseri, dünya genelinde her yıl milyonlarca insanı etkileyen ve giderek artan bir sağlık sorunu haline gelen, kompleks ve çok yönlü bir hastalıktır. Meme kanseri ile birlikte en sık rastlanan iki kanser türünden biri olan akciğer kanseri, 2 milyon yeni vakayla küresel bir meydan okumadır. Ancak akciğer kanseri, basit bir hastalık tanımının ötesine geçerek, genetik çeşitliliği ve biyolojik karmaşıklığıyla dikkat çeken, çok sayıda alt türe ayrılan bir hastalık grubu olarak karşımıza çıkmaktadır. Bu çeşitlilik, akciğer kanserinin tanı ve tedavisinde bireyselleştirilmiş yaklaşımların önemini artırmakta, her hastaya özgü tedavi stratejilerinin belirlenmesini zorunlu kılmaktadır.
Küçük hücreli dışı akciğer kanserleri (KHDAK), akciğer kanserlerinin büyük bir kısmını oluşturur ve genetik profillemeye dayalı detaylı sınıflandırmalar sayesinde, tedavi yöntemleri giderek daha hedef odaklı hale gelmiştir. Özellikle, EGFR genindeki mutasyonları içeren alt gruplar, tedavi stratejilerinin gelişiminde önemli bir yer tutmaktadır. Bu mutasyonlar, kanser tedavisinde kullanılan tirozin kinaz inhibitörlerine (TKI) duyarlılık gösteren hastalarda umut vaat eden sonuçlar ortaya koymuştur. Ancak, zaman içinde gelişen ilaç direnci, tedavi yöntemlerinin sürekli olarak yeniden değerlendirilmesini ve kişiselleştirilmiş tedavi planlarının oluşturulmasını gerektirmektedir.
FLAURA 2 Çalışması ile Gelen FDA Onayı
Etkililik, FLAURA 2 adlı açık etiketli, rastgele atamalı, ileri evre hastalık için daha önce sistemik terapi almamış EGFR ekzon 19 silinmesi veya ekzon 21 L858R mutasyon pozitif KHDAK hastaları ile yapılan 557 hastalık bir çalışmada değerlendirildi. Hastalar, ya platin bazlı kemoterapi ile osimertinib veya tek başına osimertinib alacak şekilde 1:1 oranında randomize edildi.
Ana etkililik sonuç ölçütü, araştırmacı tarafından değerlendirilen progresyonsuz (ilerlemesiz) sağkalım süresi (PFS) idi ve ana ikincil sonuç ölçütü olarak genel sağkalım (OS) olarak belirlendi.
- Platin bazlı kemoterapi ile birlikte kullanıldığında osimertinib, tek başına osimertinib kullanımına göre hastalıksız kalma süresini (PFS) önemli ölçüde artırdı. Bu durum, hastalığın ilerlemesi veya yaşam kaybı riskini yüzde 38 oranında azalttığını gösteren bir istatistikle, yani tehlike oranı 0.62 ile belirlendi. Bu oranın güven aralığı %95 ile 0.49'dan 0.79'a kadar değişiyor ve bu sonuçların çok güçlü bir istatistiksel öneme sahip olduğunu belirten p-değeri 0.0001'den daha küçüktür.
- Ortanca olarak, platin bazlı kemoterapi ve osimertinib kombinasyonu ile tedavi edilen hastaların hastalıksız kaldıkları süre 25.5 ayken, sadece osimertinib alan hastalarda bu süre 16.7 aydır. Bu, kombinasyon tedavisinin, tek başına osimertinib tedavisine göre hastaların daha uzun süre hastalığın ilerlemesini geciktirdiğini göstermektedir.
İleri evre akciğer kanseri için 25.5 aylık PFS değeri, şimdiye kadar bildirilen en iyi PFS değeridir.
Şu anda yapılan analize göre, genel sağkalım sonuçları henüz tam olarak değerlendirilmemiş durumda çünkü bu konuda final analizi yapabilmek için beklenen yaşam kayıplarının yalnızca %45'i gerçekleşmiş.
Platin bazlı kemoterapi ile osimertinib alan hastalarda en sık görülen yan etkiler (%20'den fazla) lökopeni, trombositopeni, nötropeni, lenfopeni, döküntü, ishal, stomatit, tırnak toksisitesi, kuru cilt ve artmış kan kreatinini idi.
Önerilen osimertinib dozu, hastalık ilerlemesi veya kabul edilemez toksisiteye kadar günde bir kez 80 mg oral yoldan, yiyeceklerle birlikte veya yiyeceksiz olarak alınmasıdır. Pemetrekset ve sisplatin veya karboplatin rejimleri ile birlikte kullanılabilir.
*
Osimertinib + Kemoterapi (FLAURA 2 Çalışması) ve Amivantanab + Lezertinib (MARIPOSA Çalışması) Karşılaştırması
Günümüz için FLAURA 2 ve MARIPOSA çalışmaları, ileri evre EGFR mutasyonlu KHDAK hastalarının birinci basamak tedavisinde en etkili iki tedavi seçeneğini sunmaktadır. Her iki çalışma da, bu hasta grubu için yeni tedavi kombinasyonlarının etkililiğini ve güvenliğini değerlendirmektedir, ancak farklı tedavi rejimlerini ve sonuçları karşılaştırmaktadırlar. Bununla birlikte Amivantanab + Lezertinib henüz FDA onayı almamıştır.
İlgili konu: EGFR Pozitif Akciğer Kanseri Tedavisinde Yenilikler – 2023
MARIPOSA Çalışmasının Özeti:
MARIPOSA çalışması, amivantamab ve lazertinib kombinasyonunu, daha önce tedavi almamış ileri evre EGFR mutasyonlu KHDAK hastalarında osimertinib monoterapisi ile karşılaştırmıştır. Amivantamab (bir EGFR ve MET reseptör tirozin kinaz inhibitörü) ve lazertinib (özellikle EGFR mutasyonlarını hedef alan bir tirozin kinaz inhibitörü) kombinasyonunun, osimertinib monoterapisine göre PFS'de önemli bir iyileşme sağladığı görülmüştür. Ortanca PFS, amivantamab ve lazertinib ile 23.7 ayken, osimertinib ile 16.6 ay olarak bulunmuştur. Bu sonuçlar, amivantamab ve lazertinib kombinasyonunun EGFR mutasyonlu KHDAK hastaları için yeni bir tedavi seçeneği olarak potansiyelini ortaya koymaktadır.
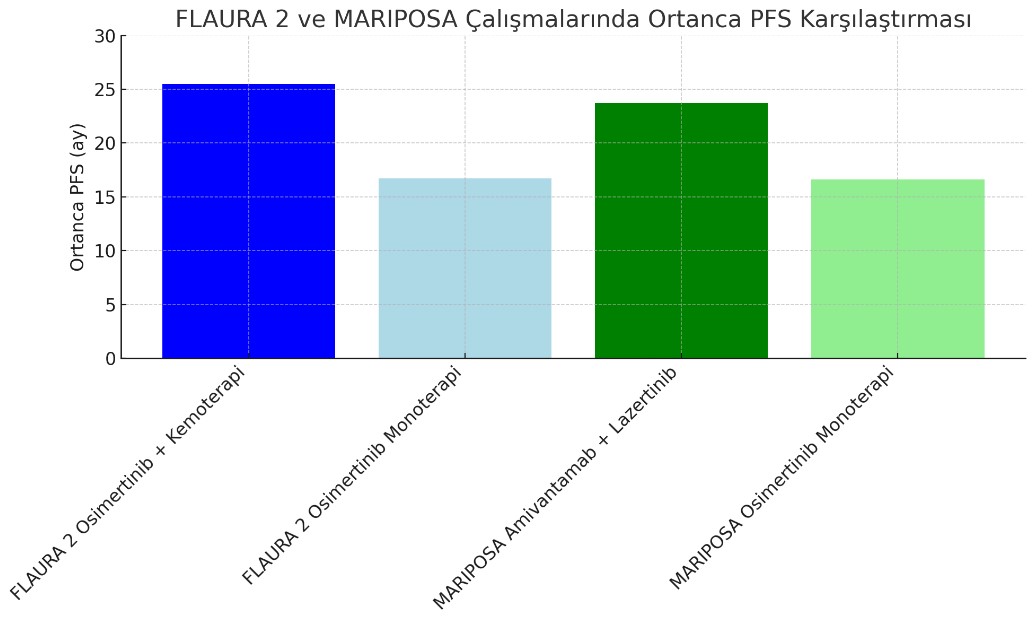
Yukarıdaki grafik, FLAURA 2 ve MARIPOSA çalışmalarında rapor edilen ortanca PFS değerlerini karşılaştırmaktadır. FLAURA 2 çalışmasında, osimertinib ve kemoterapi kombinasyonunun ortanca PFS'si 25.5 ay olarak gözlemlenirken, osimertinib monoterapisinin ortanca PFS'si 16.7 aydır. Öte yandan, MARIPOSA çalışmasında, amivantamab ve lazertinib kombinasyonunun ortanca PFS'si 23.7 ay olarak bulunmuş ve osimertinib monoterapisiyle karşılaştırıldığında, bu tedavinin ortanca PFS'si 16.6 ay olarak rapor edilmiştir. Bu görselleştirme, her iki çalışmadaki tedavi kombinasyonlarının PFS üzerindeki etkilerini göstermektedir.
Karşılaştırmalı Analiz:
-
Etkililik Açısından: Her iki çalışma da, EGFR mutasyonu pozitif ileri evre KHDAK hastalarında standart osimertinib monoterapisine alternatif olarak yeni tedavi kombinasyonlarının etkililiğini göstermektedir. Ancak, MARIPOSA çalışması, amivantamab ve lazertinib kombinasyonunun, osimertinib monoterapisine kıyasla PFS'de daha büyük bir iyileşme sağladığını rapor ederken, FLAURA 2, osimertinibin kemoterapi ile kombinasyonunun etkililiğini vurgulamaktadır.
-
Güvenlik Profili Açısından: Her iki çalışmada da tedaviyle ilişkili yan etkiler rapor edilmiştir, ancak MARIPOSA'da, amivantamab ve lazertinib kombinasyonunun, osimertinib monoterapisine göre daha yüksek oranda advers olaylara (AE'ler) yol açtığı belirtilmiştir. Özellikle, venöz tromboembolizm (VTE) gibi ciddi advers olayların, kombinasyon tedavisi alan hastalarda daha sık görüldüğü vurgulanmıştır.
-
Yönetimsel Açısından: FLAURA 2, osimertinibin zaten mevcut tedavi seçeneklerine ek olarak kemoterapi ile kombinasyonunu değerlendirirken, MARIPOSA, henüz geniş çapta FDA onayı almamış olan amivantamab ve lazertinib kombinasyonunun potansiyelini araştırmaktadır.
Sonuç olarak, her iki çalışma da ileri evre EGFR mutasyonlu KHDAK hastaları için tedavi seçeneklerini genişletme potansiyeline sahiptir, ancak her bir tedavi kombinasyonunun etkililik ve güvenlik profilleri dikkatle değerlendirilmelidir. MARIPOSA'nın sunduğu yeni tedavi kombinasyonu, özellikle tedaviye bağlı advers olayların yönetimi ve hastaların tedaviye devamlılığı açısından ek dikkat gerektirir.
FDA approves osimertinib with chemotherapy for EGFR-mutated non-small cell lung cancer. 16 Feb 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-osimertinib-chemotherapy-egfr-mutated-non-small-cell-lung-cancer






