
Önceden Tedavi Görmüş İleri Evre Özofagus Kanserinde Tislelizumab FDA Onayı Aldı
14 Mart 2024'te ABD Gıda ve İlaç İdaresi (FDA), daha önce immünoterapi almamış fakat kemoterapi görmüş, ameliyatla çıkarılamayan veya metastatik özofagus skuamöz hücreli karsinomu olan yetişkinler için monoterapi olarak tislelizumab-jsgr (Tevimbra, BeiGene Ltd) adlı anti-PD-1 yapıda bir immünoterapi ilacını onayladı.
Özofagus (yemek borusu) kanseri, dünya genelinde önemli bir sağlık sorunudur ve özellikle skuamöz (yassı) hücreli karsinom formu, bu kanser türünün en yaygın alt tipini oluşturmaktadır. İleri evre özofagus kanseri hastaları için, özellikle de hastalık ameliyat edilemez veya metastatik hale geldiğinde, tedavi seçenekleri sınırlıdır. Bu bağlamda, yeni tedavi yöntemlerinin geliştirilmesi ve onaylanması, bu hastalar için önemli bir umut kaynağı oluşturmaktadır. Geleneksel kemoterapi ve radyoterapi yöntemleri, sınırlı etkinlik göstermekte ve çoğu zaman yan etkilere neden olmaktadır. Bu durum, özofagus kanseri tedavisinde yeni yaklaşımların araştırılmasını ve geliştirilmesini zorunlu kılmaktadır.
Son yıllarda, immünoterapi, çeşitli kanser türlerinde devrim yaratan bir tedavi olarak öne çıkmıştır. PD-1/PD-L1 yolaklarını hedef alan immün kontrol noktası inhibitörleri, kanser hücrelerinin bağışıklık sisteminden kaçmasını engelleyerek, vücudun kendi kanserle savaşma kabiliyetini artırmaktadır. Özofagus kanseri tedavisinde de bu yeni yaklaşım, özellikle ileri evre hastalığı olan bireyler için yeni tedavi seçenekleri sunmuştur. Daha önce,FDA çeşitli immünoterapi ilaçlarını, hem metastatik evrede hem de neoadjuvan kemoradyoterapi almış ve tamamen rezeke edilmiş, buna rağmen rezidü hastalığı bulunan özofagus veya gastroözofageal bileşke (GEJ) kanserine sahip hastaların adjuvan tedavisi için onaylamıştır. Bu onaylar, özofagus kanseri tedavisinde immünoterapinin potansiyelini göstermiş ve bu alanda ilerlemeye yönelik umut verici adımlar atmıştır. Dahası yakın zamanda özofagus kanserinde neoadjuvan immünoterapi onayı da beklenmektedir.
İlgili konu: Özofagus Kanserinde Ameliyat Öncesi Kemoterapi artı İmmünoterapi Etkili Bulundu
RATIONALE 302 Çalışması ile Gelen FDA Onayı
Bu onay, tislelizumabın ameliyatla çıkarılamayan, bölgesel olarak ileri veya metastatik özofagus skuamöz hücreli karsinomunun ikinci basamak tedavisinde araştırmacının kemoterapi seçimine kıyasla etkinliğini ve güvenliğini araştıran küresel, randomize, açık etiketli, faz III RATIONALE 302 çalışmasına dayanmaktadır. Çalışma, Avrupa, Asya ve Kuzey Amerika'daki 11 ülkede 132 araştırma merkezinden 512 hastayı rastgele atamıştır.
RATIONALE 302, tüm hasta grubunda birincil sonlanım noktasına ulaşarak, tislelizumabın kemoterapiye kıyasla istatistiksel olarak anlamlı ve klinik olarak anlamlı bir hayatta kalma avantajı sağladığını göstermiştir.
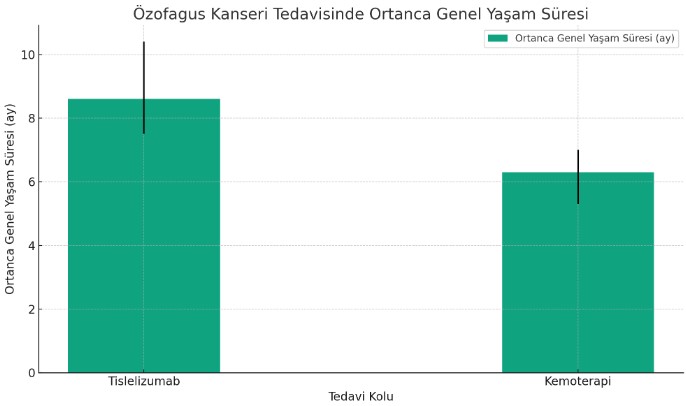
Tüm hasta grubunda,
- Tislelizumab kolu için ortanca genel yaşam süresi 8.6 ay (95% güven aralığı [CI] = 7.5–10.4 ay) iken, kemoterapi kolu için 6.3 aydı (95% CI = 5.3–7.0 ay) (P = .0001; tehlike oranı = 0.70, 95% CI = 0.57–0.85).
Tislelizumab'ın güvenlik profili de kemoterapiye göre daha olumluydu. Tislelizumab alan hastalarda en yaygın (%20'den fazla) advers reaksiyonlar, laboratuvar anormallikleri de dahil olmak üzere, artmış glikoz, azalmış hemoglobin, azalmış lenfositler, azalmış sodyum, azalmış albümin, artmış alkalen fosfataz, anemi, yorgunluk, artmış AST, kas-iskelet ağrısı, azalmış ağırlık, artmış ALT ve öksürük idi.
Sonuç olarak RATIONALE 302 çalışması, önceden tedavi görmüş özofagus skuamöz hücreli karsinomu olan hastaların tislelizumab aldığında klinik olarak anlamlı bir hayatta kalma avantajı gördüğünü göstererek, bu hastalar için önemli bir tedavi seçeneği olarak potansiyelini vurgulamaktadır.
FDA, ayrıca tislelizumabı çıkarılamayan, tekrarlayan, bölgesel olarak ileri veya metastatik özofagus skuamöz hücreli karsinomunun ve bölgesel olarak ileri evre çıkarılamayan veya metastatik mide veya gastroözofageal bileşke adenokarsinomunun birinci basamak tedavisi için biyolojik lisans başvurularını da incelemektedir. Hedeflenen aksiyon tarihleri sırasıyla Temmuz ve Aralık 2024'tür.
FDA Approves Tislelizumab for Previously Treated Patients With Advanced Esophageal Cancer. 3/15/2024 https://ascopost.com/news/march-2024/fda-approves-tislelizumab-for-previously-treated-patients-with-advanced-esophageal-cancer/






