HER2-düşük Meme Kanseri için Trastuzumab Deruxtecan (Enhertu) FDA Onayı Aldı
Ameliyat edilemeyen veya metastatik HER2-düşük meme kanseri olan yetişkin hastalar için fam-trastuzumab deruxtecan-nxki (Enhertu, Daiichi Sankyo Inc.) adlı ilaç, 5 Ağustos 2022'de FDA (ABD Gıda ve İlaç Dairesi) olayı aldı. Bu durumdaki hastalarda Enhertu kullanılabilmesi için hastanın, metastatik meme kanseri için önceden kemoterapi almış veya adjuvan (ameliyat sonrası koruyucu) kemoterapiyi tamamladıktan sonraki altı ay içinde veya adjuvan kemoterapi sırasında hastalık nüksü (tekrarı) geliştirmiş olması şartları aranmaktadır.
Meme kanseri dokusu, patolog tarafından mikroskop altında incelenirken, özel immünohistokimyasal (İHK) boyamalarla, tümörün HER2 durumu tespit edilir. Artık klasikleşen yaklaşımımıza göre, İHK boyamalarda;
- 0 HER2 "negatif"
- 1+ HER2 durumu "düşük pozitif"
- 2+ HER2 durumu "şüpheli pozitif". Bu durumda doğrulama için FISH testi ile HER2 çalışılması gerekir. FISH pozitif ya da negatif saptanırsa tümörün HER2 yönünden nihai durumuna karar verilir.
- 3+ HER2 durumu ise "pozitif" kabul edilmektedir.
Bu onaya kadar, sadece kesin pozitif (HER2 İHK 3+ veya FISH pozitif) hastalar için anti-HER2 akıllı ilaçlar onaylı idi.
DESTINY-Breast04 adlı çalışmasına, HER2 sonucu "düşük pozitif" olan (İHK 1+, İHK 2+ / FISH negatif) meme kanserli hastalar alındı.
Tümörleri HER2-düşük saptanan hastalar, tüm meme kanserli hastaların %50'sini oluşturduğu için, bu oldukça önemli bir onaydır.
DESTINY-Breast04 Çalışması ile Gelen FDA Onayı
Enhertu adlı ilacın, HER2-düşük meme kanseri tedavisinde etkinliğini gösteren DESTINY-Breast04 adlı klinik çalışmanın detaylı sonuçlarını, "Onkolojide 2022'nin En Önemli Gelişmesi" başlıklı makalemizde duyurmuştuk.
Faz-III DESTINY-Breast04 çalışmasına Asya, Avrupa ve Kuzey Amerika'da hormon reseptörü (HR) negatif veya pozitif ve HER2-düşük, daha önce bir veya iki basamak tedavi almış, ameliyatla çıkarılamayan ve/veya metastatik meme kanseri olan 557 hasta dahil edildi.
Hastalar, trastuzumab deruxtecan veya doktorun seçtiği birkaç standart kemoterapi ilacı alacak şekilde 2:1 oranında rasgele iki koldan birine atandı.
Çalışmada ölçülmesi planlanan birincil sonlanım noktası, hormon reseptörü pozitif hasta grubunda progresyonsuz (ilerlemesiz) sağkalımdı. İkincil sonlanım noktaları, tüm hastalar arasında progresyonsuz sağkalım ve hormon reseptörü pozitif grupta ve tüm hastalar arasında genel sağkalımdı.
Sonuçlar
557 hastanın 494'ünde (%88.7) hormon reseptörü pozitif hastalık ve 63'ünde (%11.3) hormon reseptörü negatif hastalık vardı.
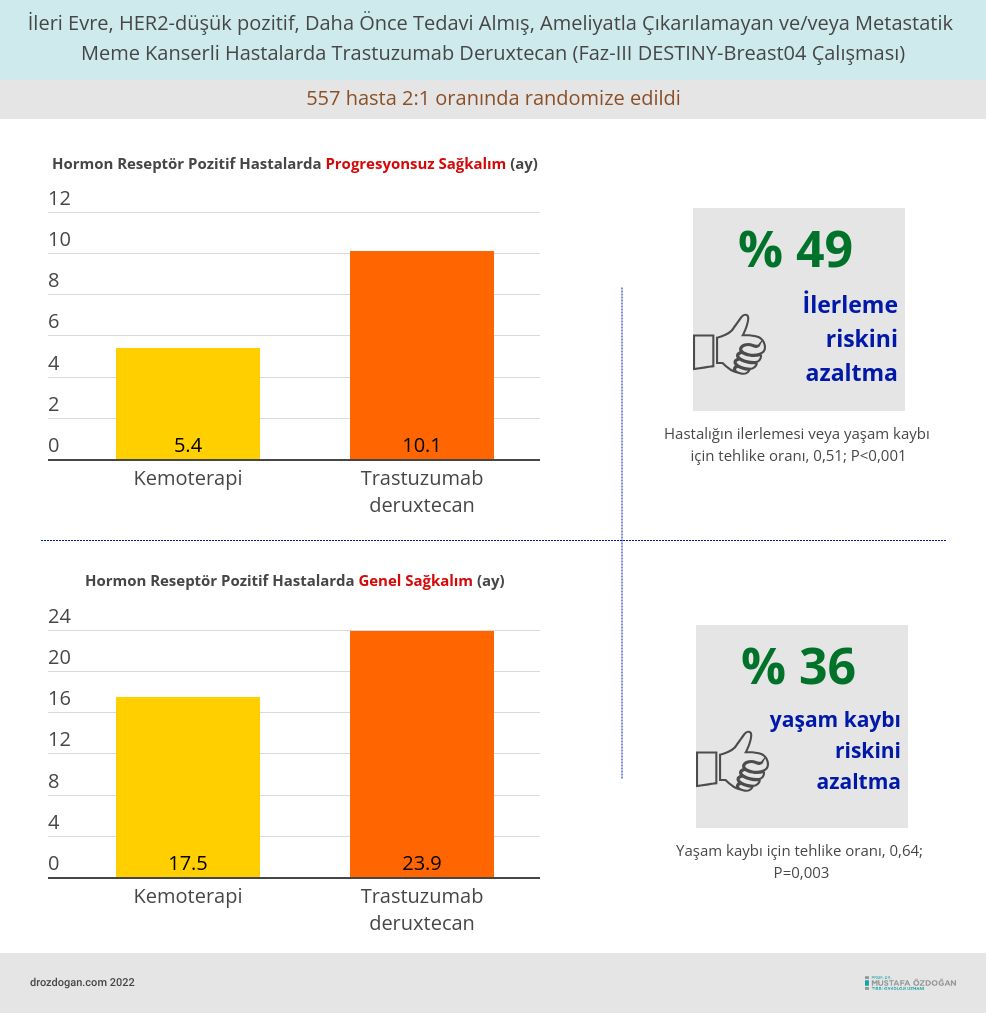
18.4 aylık ortanca takip süresinden sonra,
- Kemoterapi grubuyla karşılaştırıldığında, trastuzumab deruxtecan kolundaki hastalarda ilerleme riskinde %49 ve yaşam kaybında %36'lık bir azalma oldu.
- Grup ayrıca daha uzun progresyonsuz sağkalım (10.1 aya karşı 5.4 ay) ve genel sağkalıma (23.9 aya karşı 17.5 ay) sahipti.
Yan etkiler iki grup arasında benzer olmasına rağmen (trastuzumab deruxtecanda %52,6, kemoterapide %67,4), trastuzumab deruxtecan grubunun %12'sinde akciğer toksisitesi ve bunun sonucunda 3 yaşam kaybı meydana geldi (%0,8). Geçmişte trastuzumab almış olmak interstisyel akciğer hastalığı/pnömoni ile ilişkilendirilmiştir ve daha önceki bir metaanalizde %2,4 sıklık ve %0,2 yaşam kaybı oranı bulunmuştur.
Meme kanseri için önerilen Enhertu dozu, hastalık progresyonuna veya kabul edilemez toksisiteye kadar her 3 haftada bir (21 günlük döngü) intravenöz infüzyon olarak verilen 5.4 mg/kg'dır.
*
Trastuzumab-deruxtecan etken maddeli Enhertu adlı ilaç,
- 2019'da daha önce en az 2 basamak anti-HER2 tedavi rejimi almış ileri evre HER2 pozitif meme kanserinde,
- 2021'de daha önce tedavi almış ileri evre HER2 pozitif mide kanserinde, ve
- Mayıs 2022'de daha önce bir basamak anti-HER2 tedavi almış ileri evre HER2 pozitif meme kanserinde FDA onayı almıştı.
FDA approves fam-trastuzumab deruxtecan-nxki for HER2-low breast cancer. 5 August 2022. fda.gov






