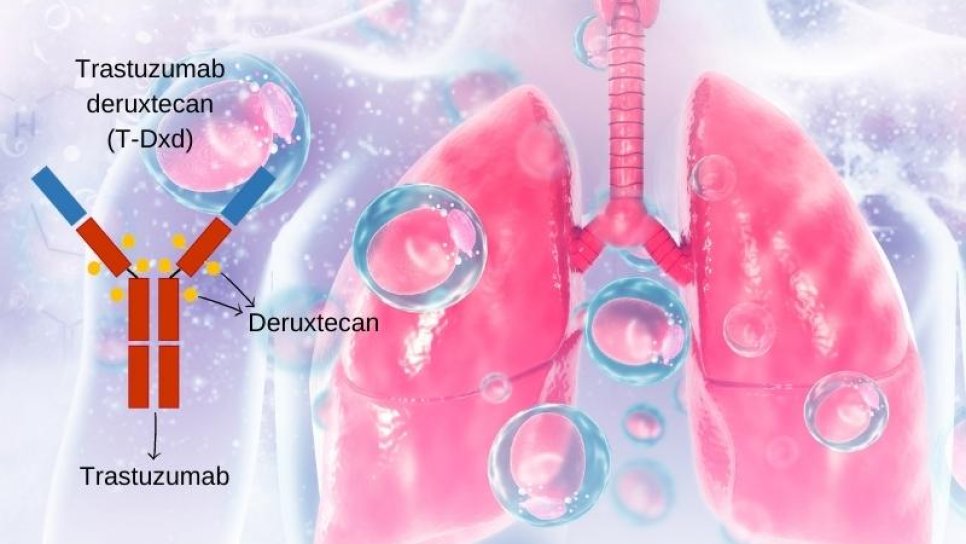
İlk Kez HER2 Mutant Akciğer Kanserinde Bir İlaç FDA Onayı Aldı: Trastuzumab Deruxtecan
Tümörleri HER2-mutasyonu pozitif, önceden sistemik tedavi görmüş, metastatik veya ameliyatla çıkarılamayan küçük hücreli dışı akciğer kanseri (KHDAK) olan yetişkin hastalar için fam-trastuzumab deruxtecan-nxki (Enhertu, Daiichi Sankyo, Inc.) adlı ilaç, 11 Ağustos 2022'de hızlandırılmış FDA (ABD Gıda ve İlaç İdaresi) onayı aldı. Bu, HER2-mutant KHDAK için onaylanan ilk ilaçtır.
Trastuzumab deruxtecan, bir kemoterapi ajanıyla HER2 reseptörüne karşı olan monoklonal antikorun bağlanmasından oluşan bir antikor-kemoterapi konjugatıdır.
FDA ayrıca Life Technologies Corporation'ın tümör dokusundan yapılan Oncomine™ Dx Hedef Testini ve kandan yapılan Guardant Health, Inc.'in Guardant360® CDx'ini, HER2 mutasyonunu tespit etmek ve Enhertu uygunluğu için yardımcı tanılama aracı olarak onayladı. Kan örneğinde mutasyon saptanmazsa, tümör dokusu test edilmelidir (bakınız kanserde genetik testler).
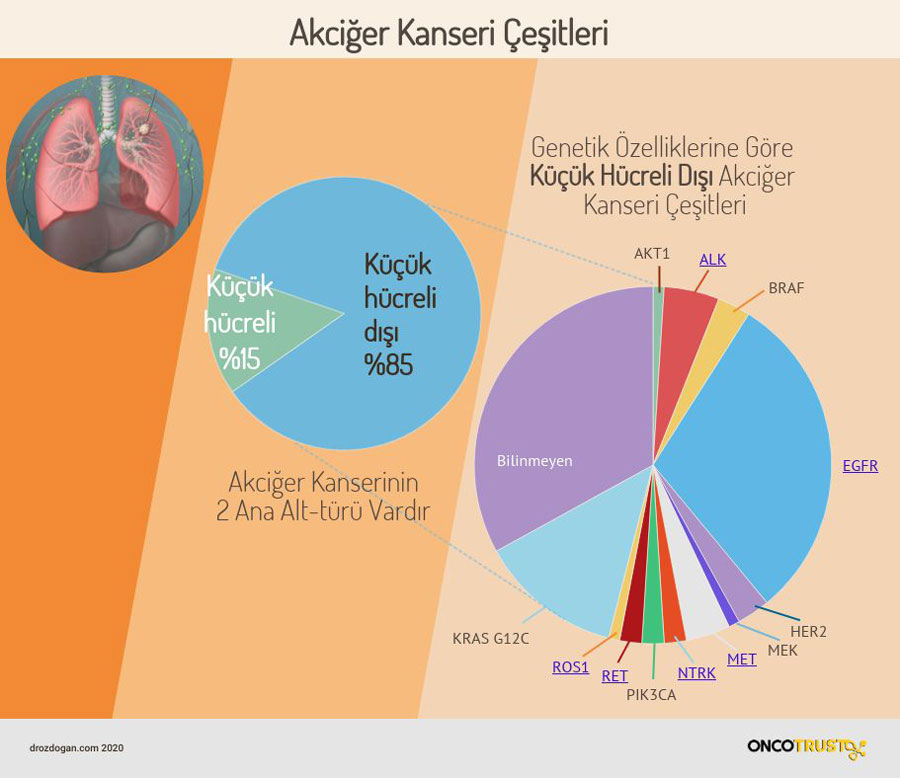
KHDAK’lerinin yaklaşık %3’ü HER2 geninde mutasyon taşır
Yassı hücreli olmayan KHDAK’lerin yaklaşık %3’ü HER2 geninde mutasyon taşır, ki bu da kadın cinsiyeti, hiç sigara içmeme ve zayıf prognoz (kötü hastalık gidişatı) ile ilişkilidir.
HER2 hedefli tedaviler – ve özellikle trastuzumab deruxtecan – daha önce meme ve mide kanseri hastalar için FDA onayı almıştı. Ancak HER2-mutant KHDAK'li hastalar için bu tür ilaçlar daha önce FDA onayı almamıştı.
DESTINY-Lung02 Çalışması ile Gelen FDA Onayı
Enhertu, çoklu denemelerde 6.4 mg/kg dozda (n=152) ve randomize doz bulma denemesinde 5.4 mg/kg dozda (n=102) değerlendirildi. Tedaviye yanıt oranları doz seviyeleri arasında tutarlıydı. Daha yüksek dozda artan interstisyel akciğer hastalığı/pnömoni oranları gözlenmiştir. Her 3 haftada bir intravenöz olarak verilen 5.4 mg/kg'lık onaylanmış önerilen dozun etkinlik sonuçları aşağıda açıklanmıştır.
Hızlandırılmış onay için etkinlik, çok merkezli, çok kohortlu, randomize, kör, doz optimizasyonu denemesi olan DESTINY-Lung02'ye dayanmaktadır. Uygun hastaların, önceki sistemik tedaviden sonra hastalık ilerlemesi olan, tümörü ameliyatla çıkarılamayan veya metastatik HER2-mutant yassı hücreli olmayan KHDAK'ye sahip olmaları gerekiyordu. Hastalar, bir tümör numunesinde aktive edici HER2 (ERBB2) mutasyonlarının varlığına dayalı olarak Enhertu ile tedavi için seçildi. Hastalar, kabul edilemez yan etki veya hastalık ilerlemesine kadar her 3 haftada bir intravenöz infüzyon yoluyla 5.4 mg/kg Enhertu aldı.
Sonuçlar
DESTINY-Lung02 çalışmasını ilk grubundaki 52 hastanın ortanca yaşı 58'di (30 ila 78 arası), %69'u kadındı; %79'u Asyalı, %12'si Beyaz ve %10'u diğer ırklardandı.
Başlıca etkililik sonuç ölçütleri, RECIST v1.1 ve yanıt süresi kullanılarak kör bağımsız merkezi inceleme ile değerlendirildiği üzere objektif yanıt oranı olarak belirlendi.
Doğrulanmış objektif yanıt oranı %58 (%95 GA: 43, 71) ve ortanca yanıt süresi 8.7 aydı (%95 GA: 7.1, tahmin edilemez [NE]).
Laboratuvar anormallikleri dahil en yaygın (≥%20) yan etkiler mide bulantısı, beyaz kan hücresi sayısında azalma, hemoglobin azalması, nötrofil sayısında azalma, lenfosit sayısında azalma, trombosit sayısında azalma, albüminde azalma, AST artışı, ALT artışı, yorgunluk, kabızlık, iştah azalması, kusma, ALP ve saç dökülmesidir. Reçeteleme bilgileri, sağlık uzmanlarına interstisyel akciğer hastalığı ve embriyo-fetal toksisite riski konusunda tavsiyede bulunan bir Kutulu Uyarı içerir.
FDA grants accelerated approval to fam-trastuzumab deruxtecan-nxki for HER2-mutant non-small cell lung cancer. fda.gov 11 August 2022






