Mesane Kanseri Birinci Basamak Tedavisi: Nivolumab, Sisplatin ve Gemsitabin FDA Onayı Aldı
Ürotelyal kanser, idrar yollarının iç yüzeyini kaplayan hücrelerden kaynaklanan ve en sık mesane kanseri olarak bilinen bir kanser türüdür. Türkiye Kanser İstatistikleri 2020'ye göre, mesane kanseri erkekler arasında en sık görülen dördüncü, kadınlar arasında ise on dördüncü kanser türüdür. Erkeklerde yeni teşhis edilen kanser vakalarının yaklaşık %7'sini, kadınlarda ise %2'sini oluşturur. Mesane kanseri vakalarının yaklaşık üçte biri tanı anında bölgesel ileri veya metastatik evrede bulunmaktadır. Bu durum, hastalığın tedavisinde yeni ve etkili yaklaşımların geliştirilmesini zorunlu kılmaktadır.
6 Mart 2024 tarihinde, ABD Gıda ve İlaç Dairesi (FDA), ürotelyal karsinomu olan yetişkin hastaların ilk tedavi seçeneği olarak cerrahiye uygun olmayan veya metastatik durumda olanlar için nivolumab (Opdivo, Bristol-Myers Squibb Company) ile sisplatin ve gemsitabinin kombinasyonunu onayladı.
CHECKMATE-901 Çalışması ile Gelen FDA Onayı
CHECKMATE-901 adlı faz 3, çok uluslu, açık etiketli çalışmaya, daha önce tedavi edilmemiş, cerrahi olarak çıkarılamaz veya metastatik ürotelyal kanserli hastalar rastgele seçilerek iki gruba ayrıldı.
Birinci grup, altı döngüye kadar her 3 haftada bir nivolumab (360 mg dozunda) ile gemsitabin-sisplatin (nivolumab kombinasyonu) aldı, ardından maksimum 2 yıl boyunca her 4 haftada bir nivolumab (480 mg dozunda) aldı. İkinci grup ise altı döngüye kadar her 3 haftada bir sadece gemsitabin-sisplatin aldı. Ana hedefler genel ve ilerlemesiz sağkalımdı.
Sonuçlar
Toplam 608 hasta randomize oldu (her grupta 304).
- Ortanca 33.6 aylık takip süresinde, nivolumab kombinasyon terapisi ile genel sağkalım, sadece gemsitabin-sisplatin ile karşılaştırıldığında daha uzundu; yaşam kaybı riskinde %22 azalma saptandı (yaşam kaybı için risk oranı, 0.78; %95 güven aralığı [CI], 0.63 ile 0.96; P=0.02).
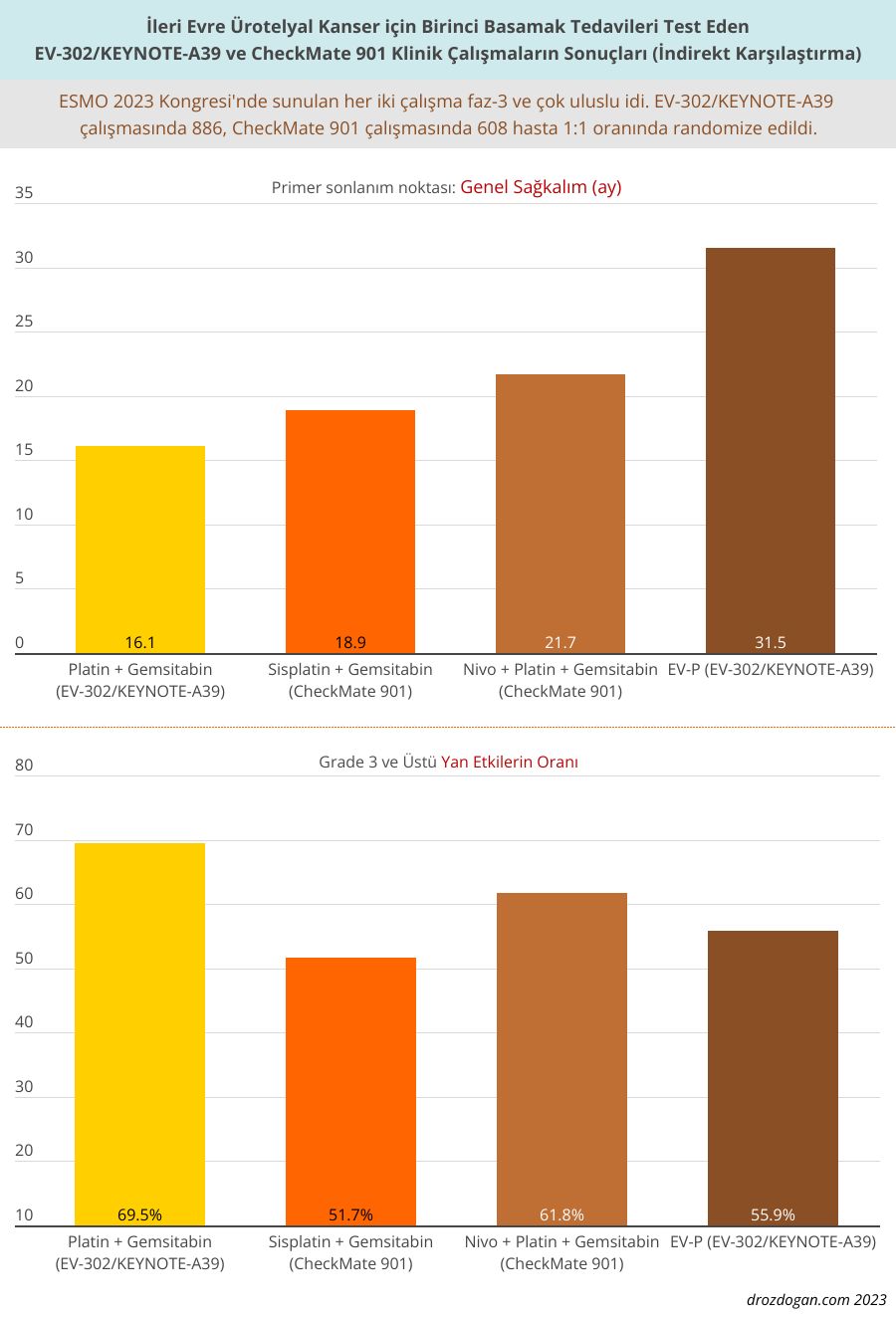
- Ortanca sağkalım sırasıyla 21.7 ay (%95 CI, 18.6 ile 26.4) ve 18.9 ay (%95 CI, 14.7 ile 22.4) idi.
- Progresyonsuz sağkalım da nivolumab kombinasyon terapisi ile sadece gemsitabin-sisplatine göre daha uzundu (ilerleme veya yaşam kaybı risk oranı, 0.72; %95 CI, 0.59 ile 0.88; P=0.001).
- Ortanca progresyonsuz sağkalım sırasıyla 7.9 ay ve 7.6 ay idi.
- 12. ayda, progresyonsuz sağkalım sırasıyla %34.2 ve %21.8 idi.
- Nivolumab kombinasyon terapisi ile genel objektif yanıt %57.6 (tam yanıt, %21.7) ve sadece gemcitabin-sisplatin ile %43.1 (tam yanıt, %11.8) idi.
- Tam yanıtın 0rtanca süresi nivolumab kombinasyon terapisi ile 37.1 ay ve sadece gemsitabin-sisplatin ile 13.2 ay idi.
- 3. derece veya daha yüksek yan etkiler sırasıyla hastaların %61.8 ve %51.7'sinde meydana geldi.
Bu endikasyon için önerilen nivolumab dozu, altı siklusa kadar her 3 haftada bir sisplatin ve gemsitabin ile birlikte 360 mg, ardından hastalık ilerlemesi, kabul edilemez toksisite veya ilk dozdan itibaren maksimum 2 yıl süreyle tek başına 2 haftada bir 240 mg veya 4 haftada bir 480 mg'dır.
İleri Evre Ürotelyal Kanserlerin Birinci Basamak Tedavisinde İmmünoterapi Artık Standart
Bölgesel olarak ilerlemiş veya metastatik ürotelyal kanseri olan hastalar için enfortumab vedotin-ejfv (Padcev) ve pembrolizumab (Keytruda) kombinasyonu 15 Aralık 2023'te FDA onayı almıştı.
Enfortumab + pembrolizumab, kemoterapisiz bir tedavi seçeneği idi. Şimdiki nivolumab + sisplatin + gemsitabin onayı ise kemoterapiye immünoterapinin ilave edildiği bir tedavi seçeneği oldu. Böylelikle, ileri evre mesane kanserlerinin birinci basamak tedavisinde immünoterapi artık standart tedavi haline geldi.
Aşağıda, yeni FDA onaylarına konu olan klinik araştırma sonuçlarının indirekt karşılaştırması görülebilir:
Sonuç
FDA'nın bu güncel onayları, ürotelyal karsinomun tedavisinde önemli bir adımdır ve hastalara yeni bir umut kaynağı sunmaktadır. Bu kombinasyon tedavileri, hastaların yaşam süresini uzatabilecek ve hastalığın ilerlemesini geciktirebilecek önemli bir seçeneklerdir.
FDA approves nivolumab in combination with cisplatin and gemcitabine for unresectable or metastatic urothelial carcinoma. 6 March 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-nivolumab-combination-cisplatin-and-gemcitabine-unresectable-or-metastatic-urothelial