
Ürotelyal Kanser için Birinci Basamakta Enfortumab Vedotin ve Pembrolizumab FDA Onayı Aldı
Lokal ileri evre veya metastatik ürotelyal kanseri olan hastalar için enfortumab vedotin-ejfv (Padcev) ve pembrolizumab (Keytruda) kombinasyonu 15 Aralık 2023'te FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
FDA, daha önce bu kombinasyona, sisplatin içeren kemoterapiye uygun olmayan lokal ileri veya metastatik evre ürotelyal kanserli hastalar için hızlandırılmış onay vermişti.
Ürotelyal kanser, idrar yolu sisteminin iç yüzeyini kaplayan ürotelyal hücrelerden köken alan bir kanser türüdür. Bu kanser çoğunlukla mesane kanseri olarak bilinir, ancak böbreklerin üst kısmındaki üreterler ve diğer idrar yolu yapılarını da etkileyebilir.
Mesane kanseri 2020 Türkiye Kanser İstatistiklerine göre 10.426 vaka ile erkekler arasında en sık görülen 4. kanser türü ve 1.772 vaka ile kadınlar arasında ise en sık görülen 14. kanser türüdür. Erkeklerdeki toplam yeni kanser vakalarının yaklaşık %7'si, kadınlardaki vakaların ise yaklaşık %2'si mesane kanseridir. Mesane kanserli hastaların yaklaşık %30'u tanı anında bölgesel ileri veya metastatik evrede bulunur.
EV-302/KN-A39 Çalışması İle Gelen FDA Onayı
Enfortumab vedotin (Padcev) ve pembrolizumab (Keytruda) kombinasyonunun, ileri evre ürotelyal kanserin birinci basamak tedavisinde yeni bir standart haline geldiğini ortaya koyan, EV-302/KEYNOTE-A39 adlı bir faz-3 çalışma idi.
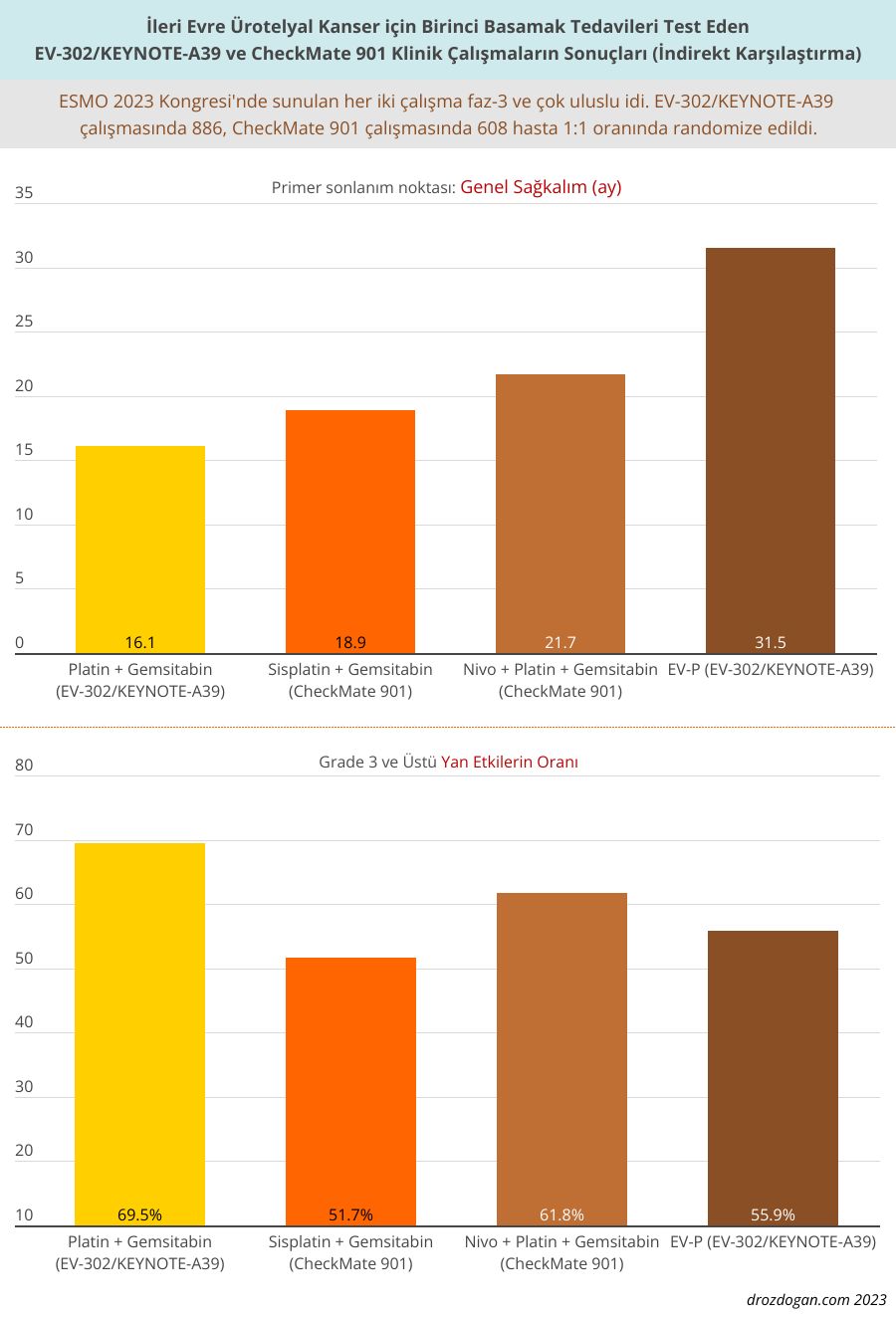
Bu kombinasyon, 442 denek üzerinde yapılan testlerde 31,5 aylık ortanca genel sağkalım ile mevcut bakım standardı olan platin-tabanlı kemoterapiyi belirgin bir şekilde geride bıraktı. Bu durum, gemsitabin ile sisplatin veya karboplatin alan 444 katılımcı üzerinde yapılan testlerde kaydedilen 16,1 aylık ortanca genel sağkalıma kıyasla, yaşam kaybı riskinde %53'lük bir azalma anlamına gelmektedir (P < .00001).
Kemoterapinin kaldırılması, yeni kombinasyonun 3. derece veya daha yüksek yan etkileri önemli ölçüde azaltmasını sağladı.
Bu, ilk basamak tedavide genel sağkalım süresini kemoterapinin ötesine taşıyabildiğimiz ilk örnektir. Enfortumab vedotin ile pembrolizumab kombinasyonu, 4. evre solid (doku/organ kaynaklı) kanserde daha önce hiç rastlanmamış bir %30 remisyon oranı sundu (Remisyon, bir hastalığın belirtilerinin ortadan kalktığı ve hastalığın ilerlemesinin durduğu bir dönemi ifade eder).
EV-302/KEYNOTE-A39 çalışması, ESMO 2023 Kongresi'nde sunulmuştu ve kongrenin en dikkat çeken çalışması olmuştu. Kongrede, EV-302/KEYNOTE-A39 çalışmasının hemen ardından sunulan ve genel sağkalımda standart platin tabanlı kemoterapiye kıyasla iyileşme gösteren bir diğer çalışma olan CheckMate 901'i geride bıraktı.
CheckMate 901 çalışmasında, kemoterapiyi tamamen iptal etmek yerine nivolumab eklendi. Her bir kol için randomize edilen 304 hastada, nivolumab eklemesi, gemsitabin/sisplatin ile elde edilen 18,9 aylık ortanca genel sağkalıma kıyasla 21,7 aylık ortanca genel sağkalım sağladı, bu da yaşam kaybı riskinde %22'lik bir azalma anlamına gelmektedir (P = .0171).
Böylelikle immünoterapinin birinci basamak kemoterapiye eklenmesinin metastatik ürotelyal kanserde sağkalımı iyileştirdiği ilk kez gösterildi.
İleri evre mesane kanserinin birinci basamak tedavilerinde yıllar süren bir durgunluk yaşandıktan sonra, bu çalışmalar oldukça kıymetli bir ilerlemeyi temsil ediyor; zira her iki çalışma da, ilk seans tedavide kemoterapiyi aşmayı başardı.
Ancak, enfortumab vedotin / pembrolizumab kombinasyonu ile elde edilen çok daha iyi sağkalım oranları, bu kombinasyonun artık "ileri evre ürotelyal kanserler için en iyi ilk basamak tedavi rejimi olduğu" anlamına geliyor.
Yan Etkiler ve Dozaj Bilgileri
Enfortumab vedotin ile pembrolizumab alan hastalarda en yaygın görülen (%20 ve üzeri) yan etkiler ve laboratuvar anormallikleri arasında artmış aspartat aminotransferaz, artmış kreatinin, döküntü, artmış glikoz, periferik nöropati, artmış lipaz, azalmış lenfositler, artmış alanin aminotransferaz, azalmış hemoglobin, yorgunluk, azalmış sodyum, azalmış fosfat, azalmış albümin, kaşıntı, ishal, alopesi, azalmış kilo, azalmış iştah, artmış ürat, azalmış nötrofiller, azalmış potasyum, kuru göz, bulantı, kabızlık, artmış potasyum, disgezi, idrar yolu enfeksiyonu ve azalmış trombositler bulunmaktadır.
Enfortumab vedotinin pembrolizumab ile birlikte önerilen dozu, hastalık ilerlemesi veya kabul edilemez toksisiteye kadar 21 günlük bir döngüde 1. ve 8. günlerde 30 dakika süreyle damar içine infüzyon yoluyla uygulanan 1.25 mg/kg'dır (≥ 100 kg olan hastalar için maksimum 125 mg). Pembrolizumabın enfortumab vedotin-ejfv ile birlikte önerilen dozu, hastalık ilerlemesi, kabul edilemez toksisite veya 2 yıllık tedaviye kadar, her 3 haftada bir damar içine infüzyon yoluyla uygulanan 200 mg veya her 6 haftada bir 400 mg'dır.
Projeler ve İşbirlikleri
Bu inceleme, FDA Onkoloji Mükemmeliyet Merkezi'nin, onkoloji ilaçları hakkında uluslararası ortaklar arasında eşzamanlı başvuru ve inceleme yapılmasını sağlayan bir çerçeve sunan Project Orbis girişimi altında yapıldı. Bu inceleme için FDA, Avustralya Terapötik Mallar İdaresi ve Sağlık Kanada ile işbirliği yaptı.
Ayrıca, bu inceleme, tüm klinik başvurunun dosyalanmasından önce veri gönderimini hızlandıran Gerçek Zamanlı Onkoloji İncelemesi pilot programını ve FDA'nın değerlendirmesini kolaylaştırmak için başvuru sahibinden yapılan gönüllü Assessment Aid başvurusunu kullandı. FDA, bu başvuruyu FDA hedef tarihinden 5 ay önce onayladı. Bu başvuru, Öncelikli İnceleme ve İleri Tedavi belirlemesi aldı.
FDA approves enfortumab vedotin-ejfv with pembrolizumab for locally advanced or metastatic urothelial cancer. fda.gov 15 Dec 2023






