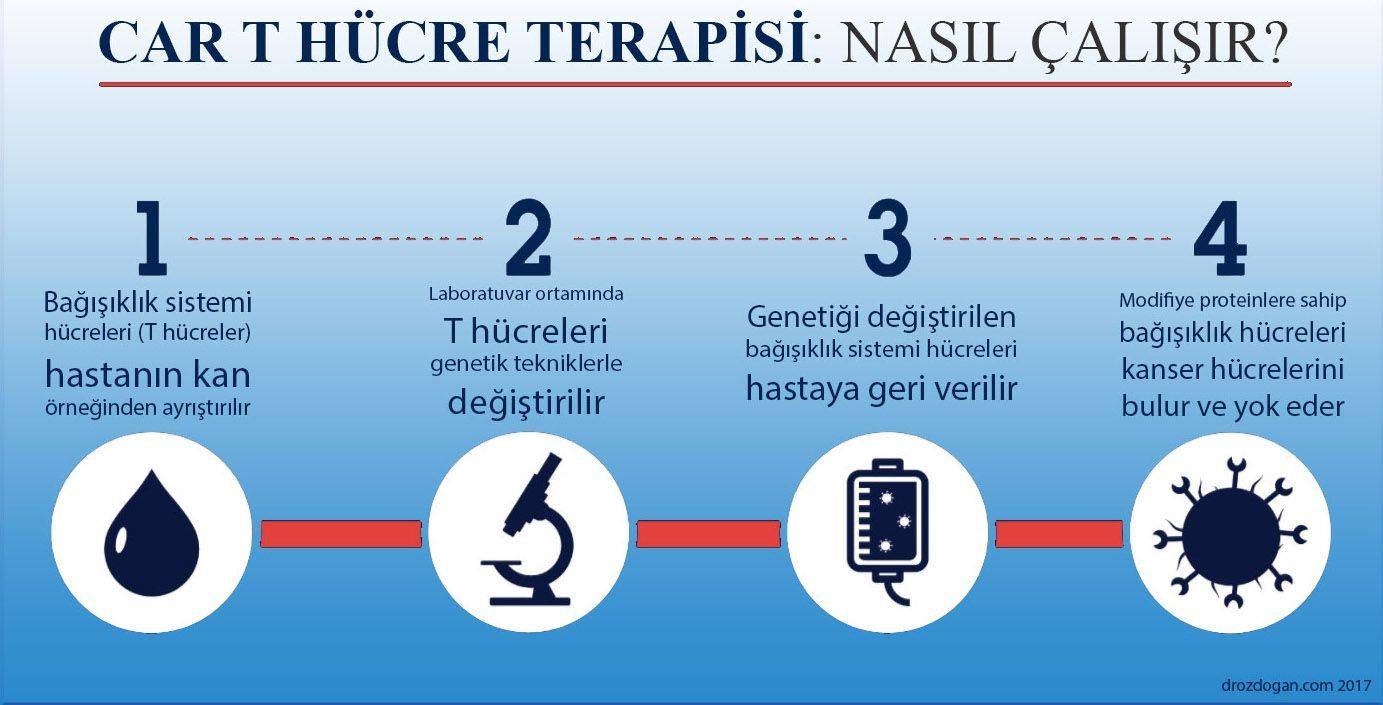
Yeni Bir CAR T-Hücre Tedavisi Öncül B Hücreli ALL İçin FDA Onayı Aldı
Tekrarlayan veya tedaviye dirençli öncül B hücreli akut lenfoblastik lösemili (ALL) yetişkin hastalar için brexucabtagene autoleucel (Tecartus, Kite Pharma, Inc.) adlı CAR T-hücre immünoterapisi, 1 Ekim 2021'de FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
Brexucabtagene autoleucelin etkinliği, tekrarlayan veya tedaviye dirençli öncül B hücreli ALL'li erişkinlerde, CD19 adlı hücre yüzey molekülüne yönelik bir kimerik antijen reseptörü (CAR) T-hücresi tedavisi olan brexucabtagene autoleuceli değerlendiren tek kollu çok merkezli bir çalışma olan ZUMA-3'te değerlendirildi. Hastalara lenfosit azaltıcı kemoterapinin tamamlanmasının ardından tek bir brexucabtagene autoleucel infüzyonu verildi.
Not: CD19 (Cluster of Differentation 19), CD19 geni tarafından kodlanan bir hücre zar proteinidir. B-lenfosit antijeni olarak da bilinir. İnsanlarda CD19, tüm B hücre soy hatlarında ifade edilir. CD19, insan B hücrelerinde iki ana rol oynar: bir yandan sitoplazmik sinyal proteinlerini zara almak için bir adaptör protein görevi görür; diğer yandan, B hücresi reseptör sinyal yollarının eşiğini azaltmak için CD19/CD21 kompleksi içinde çalışır. Tüm B hücrelerinde bulunması nedeniyle B hücre kaynaklı lösemi ve lenfomalar için hem önemli bir biyobelirteçtir hem de en popüler CAR T-hücre hedefidir.
ZUMA-3 çalışmasının detayları
Onayı desteklemek için kullanılan etkinlik sonuç ölçütleri, uygulama sonrası 3 ay içinde elde edilen tam yanıt oranı ve tam yanıt süresi idi.
- Etkinlik açısından değerlendirilebilen 54 hastanın 28'i, 3 ay içinde tam yanıta ulaştı (%52; %95 GA: 38-66).
- Yanıt verenler ortanca 7,1 ay boyunca takip edildikten sonra henüz ortanca yanıt süresine ulaşılmadı; hastaların yarısından fazlası için tan yanıt süresinin 12 ayı aştığı tahmin edilmiştir.
Brexucabtagene autoleucel için reçeteleme bilgisinde sitokin salınım sendromu ve nörolojik toksisiteler için bir uyarı bulunur. %92'sinde sitokin salınım sendromu (Derece ≥3, %26) ve %87'sinde nörolojik toksisiteler (Derece ≥3, %35) meydana geldi. En yaygın (sıklık ≥ %20) laboratuvar dışı advers reaksiyonlar ateş, sitokin salınım sendromu, hipotansiyon, ensefalopati, taşikardi, bulantı, titreme, baş ağrısı, yorgunluk, ateşli nötropeni, diyare, kas-iskelet ağrısı, hipoksi, döküntü, ödem, titreme, enfeksiyon, kabızlık, iştah azalması ve kusmadır.
Önerilen brexucabtagene otoleusel dozu, vücut ağırlığının kg'ı başına 1 x 1.000.000 (1 milyon) CAR-pozitif canlı T hücresinin (maksimum 1 x 100 milyon CAR-pozitif canlı T hücresi) tek bir intravenöz infüzyonudur, öncesinde lenfodepletif kemoterapi için fludarabin ve siklofosfamid uygulanır.

FDA approves brexucabtagene autoleucel for relapsed or refractory B-cell precursor acute lymphoblastic leukemia. fda.gov 10/01/2021