
Yeni İlaçlara Erişmek İçin Kimler Klinik Araştırmalara Katılabilir? Ülkemizdeki Durum Nedir?
İnsanlar üzerinde yapılan, bir müdahalenin etkisi ve değerini bir kontrol grubu ile karşılaştıran ve klinik bir olayı ilgilendiren ileriye dönük (prospektif) araştırmalara klinik çalışma denir.
Klinik çalışmalarda adı geçen müdahaleler ilaç, cerrahi, tıbbi cihaz ve protez, diyet, fizik tedavi, tanısal girişim veya eğitim olabilir.
Bir Klinik Çalışmaya Katılmak
Klinik bir araştırma, protokol olarak bilinen bir araştırma planına göre yürütülür. Protokol, araştırmaya özgü soruları cevaplandırmak ve katılımcıların sağlığını korumak için tasarlanmıştır. Aşağıdaki bilgileri içerir:
- Çalışmanın nedeni
- Araştırmaya kimler katılabilir (uygunluk / dahil edilme kriterleri)
- Gerekli katılımcı sayısı
- Testler, prosedürler veya ilaçların takvimi ve dozajları
- Araştırmanın süresi
- Katılımcılar hakkında hangi bilgilerin toplanacağı
Klinik Çalışmalara Kimler Katılabilir?
Klinik çalışmalar, kimlerin katılacağını açıklayan standartlara sahiptir. Bu standartlara uygunluk kriterleri denir ve protokolde listelenir. Bazı çalışmalar, üzerinde çalışılacak hastalıkları veya koşulları olan katılımcıları araştırmakta, diğer çalışmalar sağlıklı katılımcılar aramakta, ve bazı çalışmalar ise araştırmacıların kayıt yaptırması istenen önceden belirlenmiş bir grupla sınırlıdır.
Uygunluk: Bir kişinin klinik bir araştırmaya katılmasına izin veren faktörlere dahil etme ölçütleri denir ve katılımcılardan bazılarını diskalifiye eden faktörlere dışlama ölçütleri denir. Yaş, cinsiyet, hastalığın türü ve evresi, önceki tedavi öyküsü ve diğer tıbbi durumlar gibi özelliklere dayanırlar.
Klinik Çalışmalarda Katılımcılar Nasıl Korunur ve Hakları Nelerdir?
Bilgilendirilmiş onam, potansiyel ve kayıtlı katılımcılara klinik bir çalışma hakkında bilgi vermek için araştırmacılar tarafından kullanılan bir süreçtir. Bu bilgiler, insanlara çalışmaya kaydolmak veya devam etmek isteyip istemediğine karar vermelerine yardımcı olur. Bilgilendirilmiş onay süreci, katılımcıları korumaya yöneliktir ve bir kişinin, çalışma risklerini, potansiyel yararlarını ve çalışma alternatiflerini anlaması için yeterli bilgi vermelidir.
Genel olarak, bir kişi, risk, potansiyel faydalar ve alternatifler hakkında bilgi verildiğini ve anladığını göstermek için bir çalışmaya katılmadan önce bilgilendirilmiş bir izin belgesi imzalamalıdır. Belgeyi imzalamak ve rıza göstermek bir sözleşme değildir. Çalışmalar bitmese bile, katılımcılar herhangi bir zamanda bir araştırmadan çekilebilirler.
Klinik çalışmaya katılan sağlıklı veya hasta kişilerin sağlığını ve esenliğini korumak, bu alanda yetkili ulusal ve uluslararası inceleme kurulları tarafından gerçekleştirilir. Ülkemiz için Etik Kurullar, uluslararası mecrada ise başta Amerika Gıda ve İlaç Dairesi (FDA), Avrupa İlaç Ajansı (EMA) ve İnsan Hakları Araştırması Koruma Dairesi, belirli klinik araştırmaların sponsorlarının araştırma katılımcılarını yeterince koruyup korumadıklarını belirleme yetkisine sahiptir.
Klinik Çalışmaya Katılırsam Diğer Sağlık Hizmetlerinden Nasıl Faydalanırım?
Tipik olarak, katılımcılar klinik bir çalışmaya kaydolurken her zamanki sağlık hizmetlerini almaya devam eder. Ülkemiz yasalarına göre araştırma kapsamında yapılacak tüm tıbbi müdahaleler, uygulanacak prosedürler ve verilecek olan ilaçlar gönüllünün resmi veya özel sağlık sigortası kapsamında olup olmamasına bakılmaksızın araştırmanın yürütücüsü tarafından karşılanmaktadır. Katılımcının sağlık bakımının araştırma sponsorları tarafından karşılanma şartı, ülkemizde klinik araştırmaları zorlayan bir durum olarak karşımıza çıkmaktadır. Bununla birlikte, 2014 yılında yönetmelikte yapılan bir değişiklikle, araştırmacılar tarafından başvurulması halinde, kamu yararı bulunan ve Sosyal Güvenlik Kurumu (SGK) tarafından uygun görülen çalışmalarda katılımcılar sağlık hizmetini sosyal güvencelerinden almaya devam edebilirler.
Katılım Koşulları
Klinik bir araştırmaya katılmak tıbbi bilgiye katkıda bulunur. Bu çalışmaların sonuçları, tedavi edici, koruyucu ya da teşhis edici ürünlerin veya müdahalelerin yararları ve riskleri hakkında bilgi sağlayarak gelecekteki hastaların bakımı konusunda fark yaratabilir.
Klinik araştırmalar, yeni ilaçların, biyolojik ürünlerin ve tıbbi cihazların geliştirilmesi ve pazarlanması için temel sağlar. Bazen, deneysel yaklaşımın veya kullanımın güvenliği ve etkinliği deneme anında tam olarak bilinmeyebilir. Bazı denemeler katılımcılara doğrudan tıbbi yardım alma ihtimalini sağlayabilirken diğerleri bunu yapmayabilir. Birçok deneme katılımcıların çalışma protokolüne dayalı ek prosedürlere, testlere ve değerlendirmelere tabi tutulmasını gerektirir. Bu gereklilikler bilgilendirilmiş onam belgesinde açıklanacaktır. Potansiyel katılımcı, araştırma ekibinin üyeleri ve her zamanki sağlık uzmanıyla bu konuları tartışmalıdır.
Sorulacak Sorular
Klinik bir araştırmaya katılmak isteyen herkes, çalışma hakkında olabildiğince fazla bilgi sahibi olmalı ve araştırma ekibine çalışma, ilgili prosedürler ve herhangi bir masraf hakkında sorular sorarak rahatlamalıdır. Aşağıdaki sorular bu tür bir tartışma sırasında yardımcı olabilir. Bu soruların bazılarına verilen cevaplar bilgilendirilmiş onam belgesinde verilmektedir. Soruların birçoğu klinik araştırmalara özgü, ancak bazıları gözlemsel çalışmalar için de geçerlidir.
- Neyi araştırıyorsunuz?
- Araştırmacılar neden test edilen müdahalenin etkili olabileceğine inanıyorlar? Neden etkili olmayabilir? Daha önce test edildi mi?
- Çalışma boyunca alabileceğim muhtemel müdahaleler nelerdir?
- Bu denemenin olası riskleri, yan etkileri ve yararları mevcut tedavim ile kıyaslandığında nelerdir?
- Hangi testler ve prosedürler söz konusudur?
- Hastaneyi veya klinikte ne sıklıkla ziyaret etmem gerekecek?
- Çalışma ne kadar sürecek?
- Katılımımın maliyetini kim karşılayacak?
- Müdahaleden fayda sağlayacak olursam, çalışmanın bitmesinin ardından da buna devam etmesine izin verilir miyim?
- Çalışmanın sonuçları bana verilecek mi?
- Çalışmaya katıldığım sürece tıbbi bakımımı kim yönetir?
- Çalışma sırasında durumum daha kötüye giderse seçeneklerim nelerdir?
Ülkemizde Klinik Araştırmalar
Ülkemizde yeni bir klinik çalışmaya onay vermek, katılan sağlıklı veya hasta kişilerin haklarını, güvenliğini ve esenliğini korumak, bu alanda yetkilendirilmiş bağımsız Etik Kurullar tarafından gerçekleştirilir.
Sağlık Hizmetleri Temel Kanunu Ek Madde 10’a göre, insanlar üzerine bir araştırma yapılacaksa tabii ki Sağlık Bakanlığı veya bağlı kuruluşlardan onay alınması gerekiyor; bununla birlikte yapılacak araştırmayı ilgili Etik Kurul’un uygun görmesi şartı da vardır. Yani klinik araştırmalar oldukça titiz onay ve değerlendirme süreçlerinden geçmektedir.
Bununla birlikte insanlığa katkıda bulunması ve hastalıkları tedavi etmesi amacıyla geliştirilen ilaçların laboratuvar ortamında keşfedilip klinik çalışmalarla denenip başarılı olduktan sonra günlük kullanıma girmesi yıllar almaktadır.
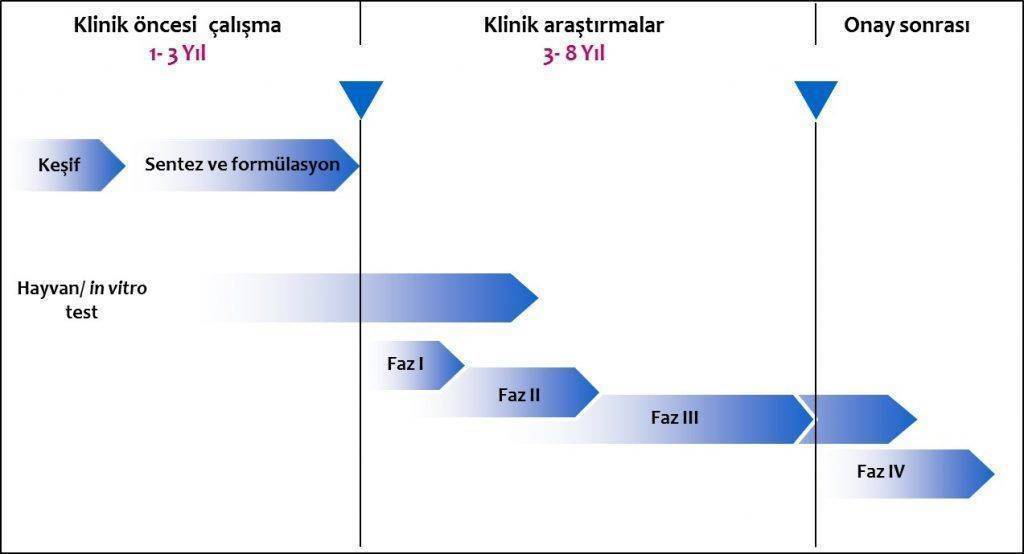
Yeni bir ilaç ancak on yılları bulan bilimsel çalışmalar ve büyük emekler sonucu kullanıma sunulabilmektedir. Klinik çalışmalardan sonra ilacın bürokratik onayları da zaman almaktadır. 2016 Avrupa Kanser Kongresi’nin (ESMO 2016) önemli konu başlıklarından biri de ilaç onay süreleriydi.
İlaç onaylarının geç alınması büyük bir problem olarak karşımıza çıkmaktadır. Öyle ki günümüzde yeni bir ilaç, çoğunlukla Amerika kaynaklı klinik çalışmalarla geliştirildiği için önce FDA, daha sonra ise Avrupa İlaç Ajansı (EMA) onayı almakta. Ülkemizde ise çoğunlukla bu ikisinde daha sonra…
Kongrede Fransadan Dr. Jean Charles Soria, klinik çalışmalardan olumlu sonuçlar elde eden ilaçların hastalarımız için klinik pratikte kullanımına kadar geçen sürenin gittikçe uzadığını, bunun ise hastalar için büyük bir kayıp olduğunu ifade etti. Çünkü ilaca erişebilme süresi uzadıkça tedaviye ulaşamayan hasta sayımız artıyor. Günümüzde FDA onayı alan bir ilacın EMA onayı alması yaklaşık 6-8 ay sürebiliyor. İlaç EMA onayı aldıktan sonra her ülke ayrıca yeniden değerlendiriyor. Sonuçta ABD’deki hastaların ulaşabildiği yeni bir ilaca Avrupa’daki hastalar ancak 1 yıl sonra ulaşabiliyor.
Klinik araştırmalar bir ülkenin sağlığı ve geleceği için yapılabileceği en değerli yatırımlardan biridir. Gelişmiş ülkelerin bu konuya büyük önem vermesi ve ödenek ayırması boşuna değildir. Ülkemizde klinik araştırma azlığı veya klinik araştırmalara ulaşamama sorununu çözebilmenin en iyi yolu, halkımıza verilecek eğitimlerle klinik araştırmalarla ilgili “insanların üzerinde deney yapılıyor” önyargısından kurtulmak, hastalarımızı uygunluklarına göre klinik araştırmalara yönlendirmek veya insani erken erişim programlarından faydalanmaktır. Böylece tüm dünya ile aynı anda hastalarımızı doğru tedavi seçeneklerine ulaştırma adına en önemli adımlardan birini atmış oluruz.
Learn About Clinical Studies.
https://clinicaltrials.gov






