Ağustos 2024'te FDA'nın Onay Vermesi Beklenen 3 Kanser İlacı
Ağustos 2024'te FDA'nın (ABD Gıda ve İlaç İdaresi) hakkında karar vermesi beklenen 3 onkoloji ilacı şunlardır:
- İleri evre sinovyal sarkom için afamitresgen otolösel (afami-cel),
- Tekrarlayan veya tedaviye dirençli multipl miyelom için linvoseltamab ve
- Kronik graft-versus-host hastalığı için axatilimab.
İleri Evre Sinovyal Sarkom için Afami-cel
FDA, ileri evre sinovyal sarkom tedavisi için afami-cel'in biyolojik lisans başvurusunu (BLA= biologics license application) öncelikli inceleme için kabul etti. Afami-cel, MAGE A4 proteinini taşıyan solid tümörlerdeki kanser hücrelerini hedeflemek için geliştirilmiş bir otolog T hücre tedavisidir.
Otolog T hücre tedavisi, hastanın kendi bağışıklık hücrelerinin (T hücreleri) alınıp laboratuvarda genetik olarak değiştirilmesi ve ardından tekrar hastaya verilmesi işlemidir. Bu tedavi, T hücrelerinin kanser hücrelerini daha etkili bir şekilde tanıyıp yok etmesini sağlar. Kan ve lenf kanserlerinden yıllardır etkili bir şekilde kullanılıyor olmasına rağmen, solid (doku-organ kaynaklı) kanserler henüz yeni yeni etkili hücresel tedaviler görüyoruz.
BLA başvurusu, faz 2 SPEARHEAD-1 çalışmasının 1. grubundan elde edilen verilerle desteklenmektedir. Bu çalışma, HLA-A*02 uygunluğu ve MAGE A4 pozitifliği bulunan metastatik veya ameliyat edilemeyen sinovyal sarkomlu 44 hasta ile miksiyoid/yuvarlak hücre liposarkomlu 8 hastada afami-cel'i değerlendirmek üzere tasarlanmıştır.
İlgili konu: Sarkomda İmmünoterapi – Mevcut Veriler ve Umut Veren Stratejiler
Hastalar, daha önce ortanca 3 basamak tedavi almışlardı. Çalışmada, tüm hastalar tek doz afami-cel aldı ve 20 hasta köprü tedavisi aldı.
Sinovyal sarkomlu hastalar arasında
- Yanıt oranı %39 idi ve yanıtın ortanca süresi 11,6 aydı.
- Ortanca progresyonsuz sağkalım 3,8 ay ve
- Ortanca genel sağkalım 16,9 ay idi.
Tüm hasta grubunda, en yaygın 3. derece veya daha yüksek tedaviye bağlı advers olaylar lenfopeni (%96), nötropeni (%85) ve lökopeni (%81) idi.
Aşağıdaki görselde, hücresel düzeyde Afami-cel gibi mühendislik destekli bir T-hücre reseptörü (TCR) terapisinin nasıl çalıştığına dair bir süreç gösterilmektedir.
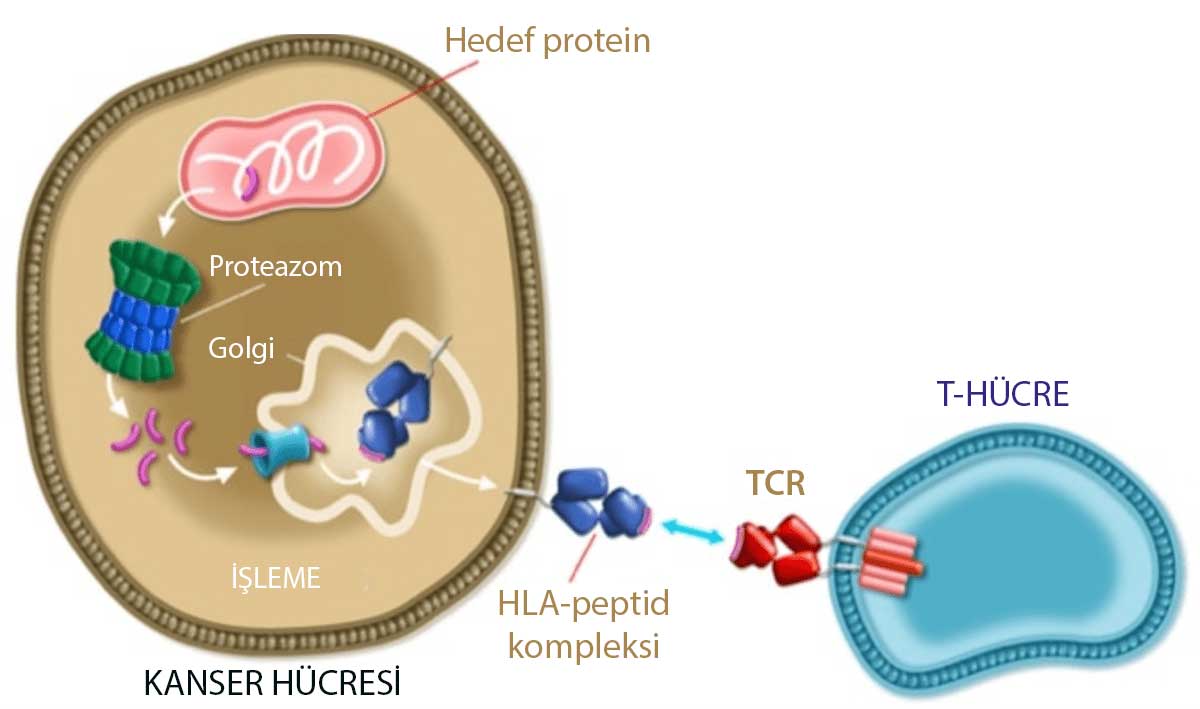
- Hedef proteini belirleme: Afami-cel, özellikle kanser hücrelerinde bulunan ve normal hücrelerde nadiren bulunan MAGE A4 gibi bir hedef proteini tanır.
- Proteini işleme: Hedef protein, hücre içindeki proteazom tarafından parçalanır ve peptid parçalarına ayrılır.
- HLA-peptid kompleksi oluşturma: İşlenmiş peptid parçaları, hücrenin yüzeyindeki HLA (Human Leukocyte Antigen) molekülleri ile birleşir. Bu kompleks, T-hücrelerinin tanıması için hücre yüzeyine taşınır.
- TCR ile tanıma ve etkileşim: Mühendislik destekli T-hücrelerin yüzeyinde bulunan T-hücre reseptörleri (TCR), bu HLA-peptid kompleksini tanır ve kanser hücrelerine spesifik olarak bağlanır.
- Kanser hücrelerine karşı etki: TCR'ların HLA-peptid kompleksine bağlanması, T-hücrelerinin kanser hücrelerini yok etmek için aktive olmasını tetikler. Bu aktivasyon, kanser hücrelerinin öldürülmesi ve böylece tümörün küçülmesi veya yok edilmesi sonucunu doğurur.
Nüks/Tedaviye Dirençli Multipl Miyelom için Linvoseltamab
FDA, nüks veya tedaviye dirençli multipl miyelomlu yetişkinlerin tedavisi için linvoseltamab'ın biyolojik lisans başvurusunu incelemektedir. Başvuru, faz 1/2 LINKER-MM1 çalışmasının verileriyle desteklenmektedir.
Bu çalışma, proteazom inhibitörü, immunomodülatör bir ilaç ve anti-CD38 antikoru dahil en az 3 önceki tedavi basamağındna sonra hastalığı ilerlemiş olan nüks (tekrarlayan) veya tedaviye dirençli multipl miyelom hastalarında linvoseltamab'ı, BCMA-CD3 hedefli bispesifik antikoru, değerlendirmek üzere tasarlanmıştır.
Çalışmaya katılan 117 değerlendirilebilir hasta vardı ve ortanca takip süresi 11,1 aydı.
- Objektif yanıt oranı %71 idi,
- Hastaların %46'sı tam yanıt veya daha iyisini,
- %62'si çok iyi parsiyel yanıt veya daha iyisini elde etti.
- Tam yanıta ulaşma ortanca süresi 7,9 ay ve parsiyel yanıta ulaşma ortanca süresi 2,6 ay idi.
Yanıtın ortanca süresi, progresyonsuz sağkalım ve genel sağkalım ulaşılmadı. 12 ayda yanıtı sürdürme olasılığı %78, 12 ayda hayatta kalma olasılığı %74,5 ve 12 ayda hayatta kalma ve progresyonsuz olma olasılığı %68,8 idi.
En yaygın tedaviye bağlı advers olaylar sitokin salınım sendromu (%46,2), nötropeni (%41,0) ve anemi (%38,5) idi.
Kronik GVHH için Axatilimab
FDA, kronik GVHH'nin tedavisi için en az daha önce 2 basamak sistemik tedavi almış hastalarda CSF-1R'yi hedefleyen bir monoklonal antikor olan axatilimab'ı incelemektedir.
Başvuru, faz 2 AGAVE-201 çalışmasının verileriyle desteklenmektedir. Bu çalışma, GVHH için daha önce 4 basamak sistemik tedavi almış 241 yetişkin ve pediatrik hastayı içermektedir.
Hastalar, axatilimab'ı 0,3 mg/kg her 2 haftada bir (80 hasta), 1 mg/kg her 2 haftada bir (81 hasta) veya 3 mg/kg her 4 haftada bir (80 hasta) dozlarında almak üzere rastgele atanmışlardır.
İlk 6 tedavi döngüsü sırasında,
- Genel yanıt oranı 0,3 mg/kg kolunda %74, 1 mg/kg kolunda %67 ve 3 mg/kg kolunda %50 idi.
Kollar arasında en yaygın advers olaylar yorgunluk, baş ağrısı ve COVID-19 idi.