Ameliyatla Çıkarılamayan veya 4. Evre Melanom için Opdualag FDA Onayı Aldı
Ameliyatla çıkarılamayan veya metastatik (4. evre) malign melanomlu 12 yaş ve üzeri yetişkin ve pediatrik hastaların birinci basamak sistemik tedavisi için nivolumab ve relatlimab-rmbw kombinasyonu (Opdualag, Bristol-Myers Squibb Company), 18 Mart 2022 taraihinde FDA (ABD Gıda ve İlaç İdaresi) onayı aldı. Opdualag, LAG-3 bloke edici antikor relatlimab ile programlanmış ölüm reseptörü-1 bloke edici antikor nivolumabın sabit dozlu bir kombinasyonudur.
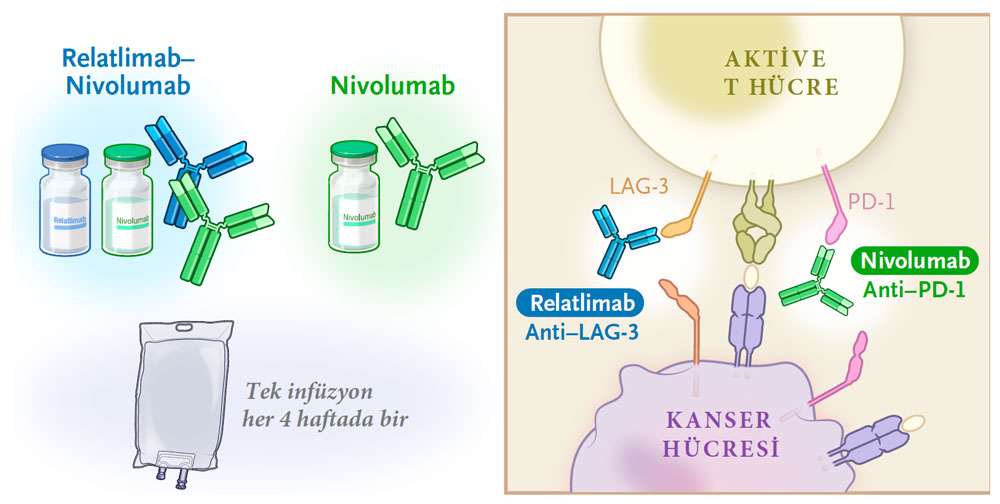
Opdualag Etki mekanizması Nasıldır?
LAG-3 ve PD-1, bağışıklık sisteminin T hücrelerini pasifleştiren iki farklı immün kontrol noktasıdır. Bir LAG-3 bloke edici antikor olan relatlimab ve bir PD-1 bloke edici antikor olan nivolumab kombinasyonunun, daha önce tedavi edilmiş melanomlu hastalarda güvenli ve antitümör aktivitesine sahip olduğu gösterilmişti, ancak daha önce tedavi edilmemiş melanomda bu kombinasyonun etkinliğini araştırmak için faz II/III RELATIVITY-047 çalışması gerçekleştirildi.
Aşağıda, relatlimab ve nivolumab etki mekanizması basitçe resmedildi:
Opdualag'a FDA Onayı Getiren RELATIVITY-047 Çalışmasının Detayları
Bu çift kör klinik araştırmaya, Kuzey Amerika, Orta Amerika, Güney Amerika, Avrupa, Avustralya ve Yeni Zelanda'daki bölgelerden 714 hasta, Mayıs 2018 ile Aralık 2020 arasında, relatlimab/nivolumab (355 hasta) veya tek başına nivolumab (359 hasta) almak üzere rastgele atandı.
Tedavi, hastalık progresyonuna veya kabul edilemez yan etkiye kadar her 4 haftada bir 160 mg relatlimab ve 480 mg nivolumab kombinasyonu ya da tek başına 480 nivolumabdan oluştu.
Tabakalaşma faktörleri;
- LAG-3 ekspresyon durumu (pozitif boyamalı immün hücrelerin ≥ %1'i veya < %1'i) ve
- PD-L1 ekspresyon durumu (tümör hücrelerinin ≥ %1'i veya < %1'i) olarak belirlendi.
Çalışmada ölçülmek istenen birincil sonlanım noktası, kör bağımsız inceleme merkezi tarafından ölçülen progresyonsuz sağkalımdı.
Sonuçlar

- Mart 2021 itibarı ile analiz yapıldığında ortanca takip süresi 13.2 aydı.
- Ortanca progresyonsuz sağkalım, relatlimab/nivolumab grubunda 10.1 aydı (%95 güven aralığı [GA] = 6.4–15.7 ay), nivolumab grubunda ise 4.6 aydı (%95 GA = 3.4–5.6 ay) (tehlike oranı [HR ] = 0.75, %95 GA = 0.62–0.92, P = .006).
- 12. ayda PFS oranları %47.7 (%95 GA = %41.8-%53.2) ve %36.0 (%95 GA = %30.5-%41.6) idi.
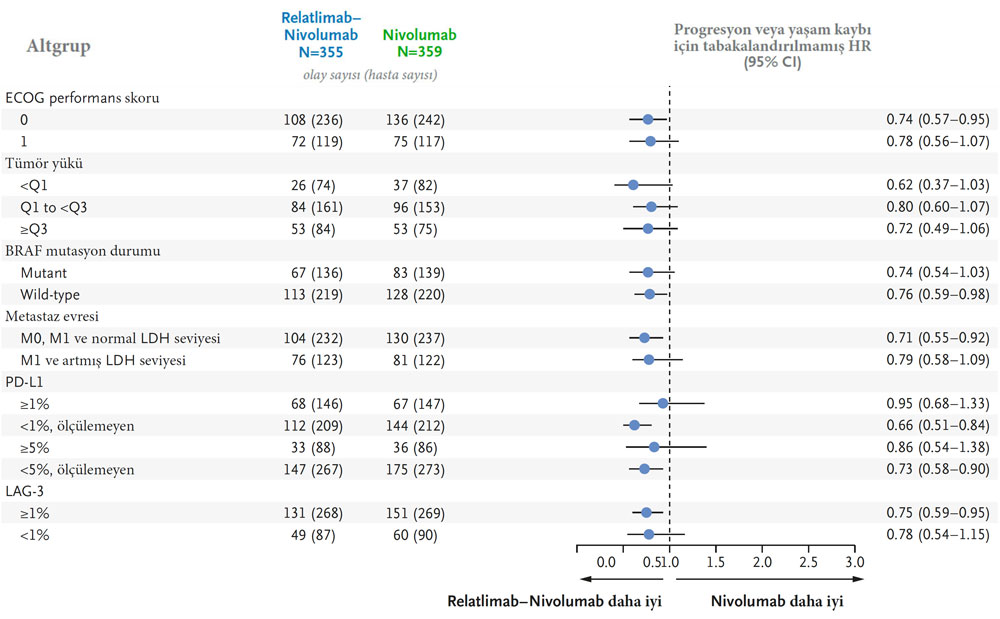
- Kombinasyon tedavisi, tümör yükü, LDH seviyesi ve diğer prognostik faktörlerden bağımsız olarak daha iyi progresyonsuz sağkalım gösterdi.
Opdualag Yan Etkileri
- Ciddi (3. veya 4. derece) yan etkiler, relatlimab/nivolumab grubundakilerin %40.3'ünde ve nivolumab grubunun %33.4'ünde meydana geldi ve %18.9'a karşı %9.7'sinde tedaviyle ilişkili olarak kabul edildi.
- Relatlimab/nivolumab grubunda herhangi bir derecedeki tedaviye bağlı en yaygın yan etkiler kaşıntı (%23.4'e karşı %15.9), yorgunluk (%23.1'e karşı %12.8) ve döküntüdür (%15.5'e karşı %12.0); en yaygın 3. veya 4. derece yan etki yorgunluktu (%1.1'e karşı %0.3).
- İnfüzyonla ilişkili reaksiyonlar hastaların %5,9'una karşı %3,6'sında meydana geldi.
- Relatlimab/nivolumab grubunda herhangi bir derecedeki en yaygın immün aracılı yan etkiler hipotiroidizm veya tiroidit (%18.0'e karşı %13.9), döküntü (%9.3'e karşı %6.7) ve diyare/kolit (%6.8'e karşı %3.1); en yaygın 3. veya 4. derece olaylar hepatit (%3.9'a karşı %1.1) ve adrenal yetmezliktir (%1.4'e karşı %0).
Opdualag Dozu
En az 40 kg ağırlığındaki 12 yaş ve üstü yetişkin ve pediatrik hastalar için önerilen Opdualag dozu, hastalık progresyonu veya kabul edilemez toksisite meydana gelene kadar 4 haftada bir intravenöz olarak uygulanan 480 mg nivolumab ve 160 mg relatlimabdır. 12 yaş ve üzeri, 40 kg'ın altındaki pediyatrik hastalar için önerilen doz belirlenmemiştir.
FDA approves Opdualag for unresectable or metastatic melanoma. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-opdualag-unresectable-or-metastatic-melanoma 21.03.2022