CAR NK: Doğal öldürücü bağışıklık hücreleri ile kanser tedavisinde yeni dönem
T hücrelerin modifiye edilerek oluşturulması ile elde edilen CAR T tedavileri, ilk kez 2017'de lösemi ve lenfoma için ABD Gıda ve İlaç İdaresi (FDA) onayı almıştı ve kanser tedavilerinde yeni bir hücresel immünoterapi dönemi başlamıştı. Şimdi ise daha etkili ve daha az yan etkili yeni bir canlı kanser ilacı ile karşı karşıyayız: CAR NK hücre tedavisi.
Bağışıklık sisteminin "doğal katil" (narutal killer = NK) hücreleri, doğuştan gelen bağışıklık sistemine ait bir hücre grubu olup ilk kez 1975 yılında farede keşfedilmiştir. Farklı hücre yüzey reseptörlerine sahip olan NK hücreleri sağlıklı dokular arasında farklı dağılım özellikleri göstermekle birlikte çoğunluğu kan, karaciğer, dalak ve kemik iliğinde bulunur. Küçük bir kısmı da lenf kodlarında bulunmaktadır. NK hücreleri, vücudu patojenlerden korumak için birinci sırada yer almaktadır. Normal vücut hücrelerinin virüs ile istila edilmesi durumunda, daha önce karşılaşmaya gerek duymadan hızla aktif hale gelir ve koruyucu yanıtlar oluşturur.
Teknolojinin gelişmesi ile birlikte son yıllarda yapılan çalışmalar, tümör immünolojisini / bağışıklık sistemi ilişkisini daha iyi anlamamızı sağlamaktadır. NK hücreleri ile yapılan çalışmalar, araştırmacılar için son derece ilgi çekicidir. Bir donörün / vericinin kemik iliği, insan embriyonik kök hücre, uyarılmış pluripotent kök hücre, periferal kan, göbek kordon kanı gibi çeşitli kaynaklardan elde edilerek hastaya transfer edilen NK hücrelerinin tümöre karşı daha güçlü yanıtlar oluşturduğu keşfedildi. Ancak bu NK hücrelerinin izole edilmesi ve laboratuvar ortamında çoğaltılması son derece zor bir işlemdir. Hücre klonlama teknolojisinin faydaları sayesinde aynı özelliklere sahip, yüksek saflık ve fonksiyonel özellikte tutarlı NK hücre hatları oluşturulmuştur; KHYG-1, NK-92, NKL, NKG ve YT. Bu hücre hatları büyük ölçeklerde deneyler yapılmasını kolaylaştırmıştır. NK-92 hücre hattının CAR (chimeric antigen receptor) ile modifiye edilmesi sonucunda güçlü bir anti-tümör özellik sergilemesi, klinik olarak kullanımının önünü açmıştır.
NK hücreleri yüzeylerinde farklı biyobelirteçler sergilemekle birlikte CD56 ve CD16 hücre yüzeyi belirteçleri en dikkat çekenlerdir. CD56 ve CD16 sergileme yoğunluklarına göre NK hücreleri iki gruba ayrılmaktadır: CD56bright ve CD56dim.
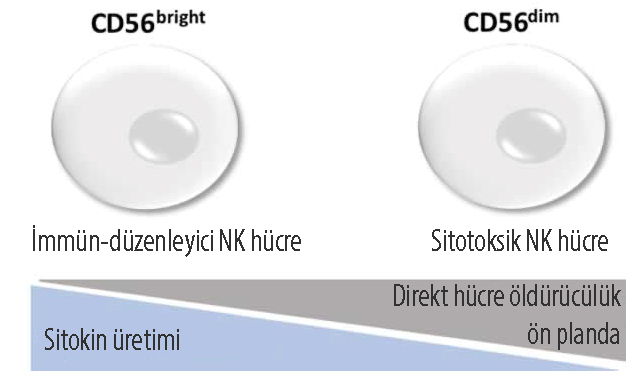
CD56dim NK hücreleri tamamen olgunlaşmıştır ve kanda bulunan NK hücrelerinin yaklaşık %90’ını oluşturan hücre grubudur. Sitotoksik / hücre öldürücü yanıttan sorumlu olan bu hücre grubu, antikora-bağımlı hücre aracılı sitotoksisitede rol almaktadır. Diğer yandan CD56bright NK hücreleri, olgunlaşmamış ve çoğunlukla doku ve ikincil lenf organlarında bulunan bir gruptur. CD56bright hücreleri yüzeylerinde çok az miktarda CD16 sergilemektedirler. Bu nedenle, bu grup hücrenin bağışıklık yanıtındaki asıl rolü interferon (IFN)-gama, tümör nekroz faktör (TNF)-alfa, granülosit makrofaj koloni uyarıcı (GMCS) faktör, IL-10, IL-13 gibi sitokinleri salgılamaktır.
NK hücreleri ‘yabancı’ları yüzeylerinde sergiledikleri ‘aktive edici NK reseptörleri’ ve ‘baskılayıcı NK reseptörleri’ yardımı ile tanımaktadırlar. Bu reseptörler, vücutta tüm çekirdekli hücrelerin yüzeyinde bulunan major histokompablite kompleks I (MHC-I) molekülünü tanırlar. Bu durum, karşı hücrenin sağlıklı olduğunu göstererek, baskılayıcı NK reseptörünü harekete geçirir ve NK hücreleri hedefi yok etmez.

Yukarıdaki şeklin açıklaması: a) Kendinden / dost hücre: NK hücresi, hücre yüzeyinde bulunan MHC-I molekülünü tanıyarak hedef hücreyi yok etmekten vazgeçer. b) Eksik kendinden hücre: Hedef hücre, yüzeyinde MHC-I molekülünü sergilememektedir. Bu durumda NK hücresi aktive edici reseptörlerinden uyarıcı sinyaller alarak hücreyi yok etmeye başlar. c) Stresli hücre: Hedef hücre yüzeyinde, değiştirilmiş MHC-I veya stres kaynaklı moleküller sergilediğinde NK hücreleri tarafından tanınarak yok edilir. d) Kendinden olmayan hücre: Hedef hücre yüzeyinde yabancı MHC-I sergiler ve NK hücrelerinin sitotoksik mekanizmalarını uyarır. Böylece hedef hücre yok edilir.
Sağlıklı hücrelerin virüs ile istila edilmesi veya tümör oluşumu durumunda yüzeyde sergilenen MHC-I molekülü kaybolur. Böylece aktive edici NK hücre reseptörü harekete geçer ve üç farklı yolak ile hedef hücreyi yok eder:

- Perforin/Granzim yolu: NK hücrelerinin içerisinde bulunan keseciklerde depolanan perforin, hücre dışına salınarak hedef hücre yüzeyinde geçirgenliği arttırır. Ardından gönderilen granzim apoptoza neden olarak, hücreyi ölüme götürür.
- Fas/FasL yolu: Fas ve FasL adı verilen iki molekülün birleşmesi ile hedef hücreye ölüm sinyali verilmekte ve birkaç saat içerisinde apoptoz ile yok edilmektedir.
- Sitokin yolu: NK hücreleri TNF-alfa gibi salgıladıkları sitokinler ile hedef hücrenin lizozom stabilitesini bozmaktadır. Böylece, hedef hücrenin DNA’sını parçalayacak hidroliz enzimleri serbest bırakılır ve hücre yok edilir.
NK-92 hücreleri
NK-92 hücre hattı Amerikan Gıda ve ilaç Daire (FDA) tarafından faz 1 ve faz 2 klinik çalışmalarda kullanılmak üzere onaylanan tek NK hücre hattıdır. NK-92 neredeyse hiç ‘’baskılayıcı reseptör’ bulundurmamakla birlikte, bol miktarda ‘’aktive edici’ reseptör sergilemektedir. Aynı zamanda yüksek miktarda perforin ve granzim içeriyor oluşu, geniş ölçekte sitotoksik etkinliği olduğunu göstermektedir.
Kanser tedavisindeki etkinliğini değerlendirmek için NK-92 hücre hattı ile birçok çalışma yapılmıştır. Örneğin, lösemi ve nyelom hücreleri ile yapılan çalışmalarda NK-92 hücrelerinin, güçlü bir sitotoksik etkisinin olduğu ve etkili bir şekilde yok ettiği belirlenmiştir.
Kimerik antijen reseptörleri (CAR) ve NK-92 hücre hattı
CD19 hedefli CAR T hücre tedavisinin FDA tarafından onay almasına rağmen, bu yöntemin pek çok kısıtlamaları vardır; istenmeyen yan etkiler ve sitokin fırtınası bunların başında gelmektedir. CAR T hücre tedavisi solid / katı tümörlerde başarılı sonuçlar vermemekte ve hastanın kendisinden elde edilen T hücreler ile üretimi sırasında uzun zaman alması ve yeterli sayıda hücre toplamanın zor olması gibi bir takım olumsuz durumlar görülmektedir. Donörden T hücre elde edilerek bu zorluklar aşılabilecek olsa da bu yöntemin de organ fonksiyon bozukluğuna neden olan graft-versus-host hastalığına neden olma riski bulunmaktadır.
CAR NK-92 hücrelerinin yüksek sitotoksik özelliklere sahip olması ve homojen olarak elde edilen hücrelerin kısa sürede yüksek miktarda üretilebilmesi en büyük avantajların başında gelmektedir.
Aynı zamanda vücutta yaşam sürelerinin CAR-T hücrelerine göre daha kısa olması, oluşabilecek yan etkileri azaltmaktadır.
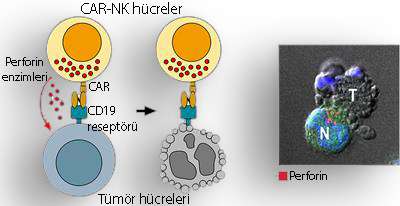
Aşağıda, anti-CD19 CAR-NK tedavisinin etki mekanizması basit bir şekilde özetlenmektedir.
CAR NK-92 hücre tedavisinin avantajları nelerdir?
CAR NK-92 hücre tedavisi, sahip olduğu pek çok avantaj ile CAR T hücre tedavisine rakip olmaktadır. Bu avantajlar arasında;
- CAR NK-92 hücre tedavisi graft-versus-host hastalığına neden olmamakta ve daha etkili sitotoksik etkiye sahiptirler.
- CAR NK-92 hücreleri tümörü doğrudan hedefleyebilir ve NK-92 hücre aktivasyonu ile hedef hücreyi yok edebilir.
- Tümör yüzeyinde hedeflenmiş antijenin kaybolması durumunda dahi CAR NK-92 hücreleri ‘aktive edici reseptör’leri sayesinde aktif olmaya devam ederler.
- ‘Baskılayıcı reseptör’ler NK-92 hücrelerinin yüzeyinde düşük oranda sergilenmektedir ve var olan reseptörlerin de silinmesi NK-92 hücrelerini solid tümörler için diğer bağışıklık hücrelerine göre daha dayanıklı yapmaktadır.
- Ölümsüz olan NK-92 hücreleri, stabil bir fenotipe / görünüme sahiptir ve laboratuvar ortamında uzun süre çoğaltılabilir.
- CAR T hücre tedavisi için gerekli olan T hücrelerinin hastanın kendi kanından toplanması gerekmektedir. Ancak kişide yeterli sayıda T hücresinin bulunmaması ya da bulunan hücrelerde birtakım bozuklukların olması nedeni ile tümör hücrelerini tanımada yetersiz olması karşılaşılan sorunların arasında yer almaktadır. Aynı zamanda, kişinin kendisi tek seferde sadece 1 doz CAR-T üretebilir ve bu da maliyetleri arttırmaktadır. Ancak, NK hücreleri için böyle bir kısıtlama bulunmamaktadır. Donörden toplanan NK hücreleri de CAR-NK tedavisi için kullanılabilir.
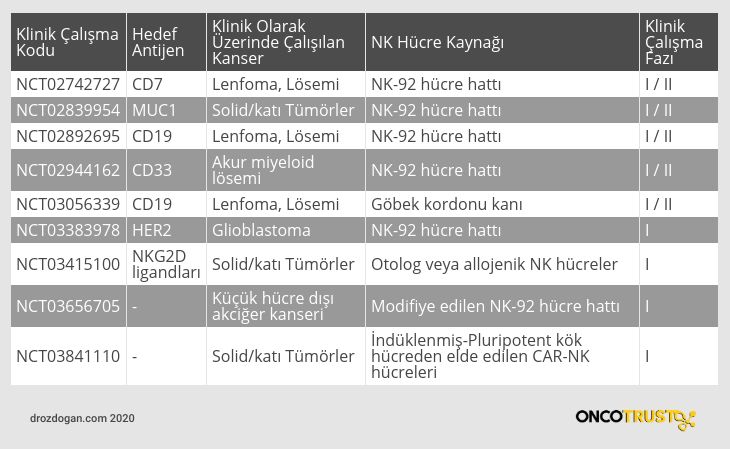
Aşağıda, CAR NK hücre terapisinin denendiği kanser klinik araştırmaları görülebilir:
CAR NK-92 hücre tedavisinin zorlukları nelerdir?
Etkili bir anti-tümör özelliklerinin olmasının yanında, hala daha çözülmesi gereken problemler bulunmaktadır:
- NK-92 hücre hattı kötü huylu Hodgkin olmayan lenfoma hastalarından elde edilmiştir. Bu durum ikincil bir tümör oluşumuna neden olabilir. Aynı zamanda NK-92 hücre transferinden sonra Epstein-Barr virüsüne duyarlılığına sebep olabilir. Bu nedenle, güvenilirliğini arttırmak için klinik uygulama öncesinde, ışına maruz bırakılarak olası yan etkilerin önü kesilmelidir. Yapılan çalışmalar ışına maruz kaldıktan sonra dahi NK-92 hücreleri çoğalma ve öldürücü özelliklerini korumaya devam etmektedirler.
- Yüksek dozda ışına maruz kalma sonucunda, NK-92 hücrelerinin yarı ömürleri kısalmaktadır. Bu durum da beraberinde anti-tümör özelliklerin azalmasına neden olur. Bu durumu engellemek için, birden fazla CAR NK-92 enjeksiyonuna gerek duyulabilir.
- CAR ekspresyonunu NK hücrelerde başlatmak için en sık kullanılan yöntem viral vektörlerin kullanıldığı genetik modifikasyon tekniğidir. Bu amaçla farklı vektörler kullanılabilir. Amaç, CAR ekspresyonunu sağlayacak genetik bilginin NK hücresine yerleşmesini sağlamaktır. Ancak, bu yöntem beraberinde bazı olumsuz durumları da getirebilir. Örneğin, kullanılan vektörlerin maliyeti yüksek, üretim döngüsü uzun ve karmaşık olabilir. Aynı zamanda, kullanılan vektörler aracılığı ile istenilen genetik bilginin istenilen bölgeye ekleneceğinin bir garantisi yoktur. Bu durum normal genlerin zarar görmesine ve anormal hücre döngülerinin başlamasına neden olabilir. Bu sorunları ortadan kaldırmak için son yıllarda kullanıma başlanan yöntem CRISPR-Cas9 sistemidir.
- CAR NK-92 hücreleri tümör üzerinden bulunan spesifik bir antijeni hedef alarak saldırıya geçer. Ancak bu antijenlerin sağlıklı vücut hücrelerinde de salgılanıyor olması durumda istenmeyen toksik etkiler meydana gelebilir. Bu nedenle, tedaviyi güvenli sınırlar içinde tutmak için uygulanacak doz miktarına dikkat edilmelidir.
- Vücut koşullarında yaşam sürelerinin kısa olması CAR NK hücreleri ile yapılan tedavide kısıtlamalar getirmektedir. Son yapılan çalışmalardan çıkan sonuçlar, hafıza NK hücrelerinin uzun yaşam süreleri ve uzun süreli aktivitelerinden dolayı CAR NK adoptif hücre tedavisi için daha uygun olabileceğini düşündürmektedir.