
Cemiplimab ve Platinli Kemoterapi, Akciğer Kanseri için Birinci Basamakta FDA Onayı Aldı
İleri evre küçük hücreli dışı akciğer kanseri (KHDAK) olan, tümörlerinde EGFR, ALK ve ROS1 mutasyonları olmayan hastalar için platin-bazlı kemoterapi ile kombinasyon halinde cemiplimab-rwlc (Libtayo, Regeneron Pharmaceuticals, Inc.) adlı immünoterapi, 8 Kasım 2022'de FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
Cemiplimab için 4. FDA Onayı
Anti-PD-1 sınıfından bir immünoterapi olan cemiplimab daha önce 2018 yılında yassı hücreli cilt kanseri, 2021 yılında bazal hücreli cilt kanseri ve yine 2021 yılında PD-L1 TPS>=%50 küçük hücreli dışı akciğer kanseri birinci basamak tedavisi olarak FDA onayı almıştı.
KHDAK Birinci Basamak Tedavisinde 4. İmmünoterapi-Kemoterapi Onayı
Bu immünoterapi-kemoterapi kombinasyonu, ileri evre küçük hücreli dışı akciğer kanseri (KHDAK) birinci basamak tedavisinde, PD-L1'den bağımsız bir şekilde FDA onayı alan 4. tedavi oldu. Daha önce "pembrolizumab", "atezolizumab" ve "nivolumab-ipilimumab" immünoterapileri, platin-bazlı kemoterapi ile kombinasyon halinde, bu durumdaki hastaların tedavisinde kullanılmak üzere onay almıştı.
Study 16113 ile Gelen FDA Onayı
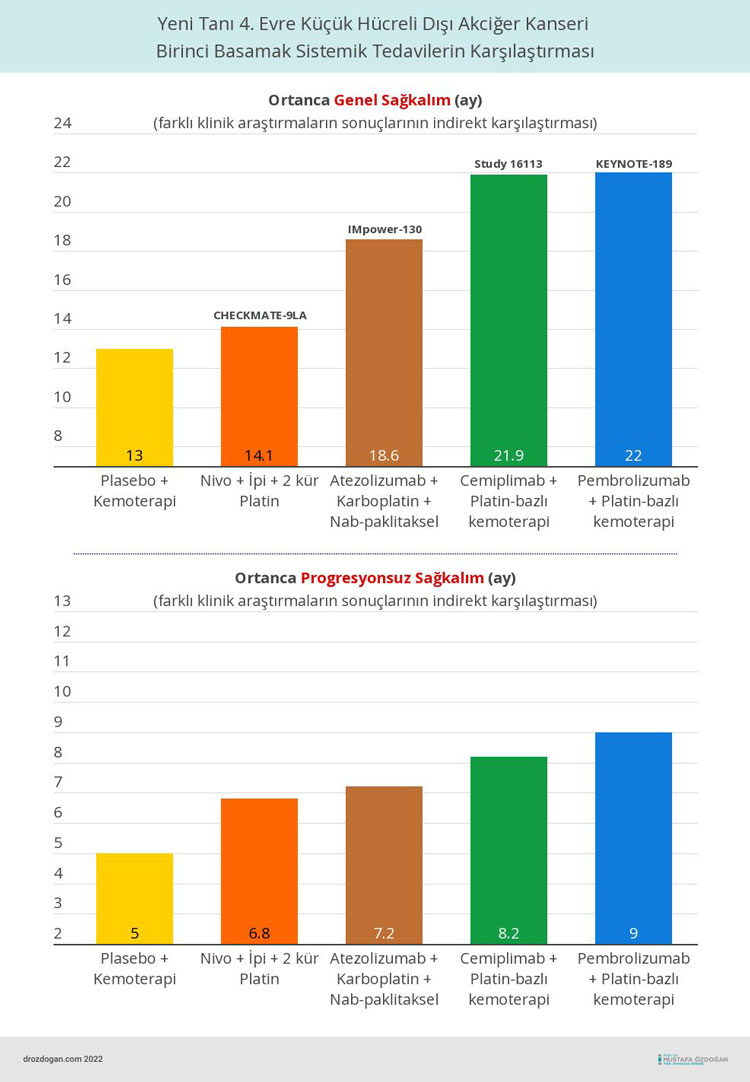
Cemiplimabın etkinliği, daha önce sistemik tedavi almamış ileri evre KHDAK'li 466 hastada randomize, çok merkezli, çok uluslu, çift kör, aktif kontrollü bir çalışma olan Study 16113'te değerlendirildi. Hastalar, 4 kür için 3 haftada bir cemiplimab-rwlc artı platin bazlı kemoterapiye, ardından cemiplimab-rwlc ve idame kemoterapisine veya 4 kür için 3 haftada bir plasebo artı platin bazlı kemoterapiye, ardından plasebo ve idame tedavisine 2:1 oranında randomize edildi.
Çalışmada ölçülmek istenen ana etkinlik sonuç ölçüsü genel sağkalım idi. Ek etkililik sonuç ölçütleri, kör bağımsız merkezi inceleme tarafından değerlendirildiği üzere progresyonsuz (ilerlemesiz) sağkalım ve genel yanıt oranı idi.
Sonuçlar
- Cemiplimab artı platin bazlı kemoterapi, plasebo artı kemoterapiye kıyasla genel sağkalımda istatistiksel ve klinik olarak anlamlı bir iyileşme gösterdi: yaşam kaybı riskinde %29 azalma (tehlike oranı [HR] 0,71 [%95 GA: 0,53, 0,93], iki taraflı p-değeri = 0,0140).
- Ortanca genel sağkalım, cemiplimab artı kemoterapi kolunda 21.9 ay (%95 GA: 15.5, değerlendirilemez) ve plasebo artı kemoterapi kolunda 13 aydı (%95 GA: 11.9, 16.1).
- Ortanca progresyonsuz sağkalım, cemiplimab artı kemoterapi kolunda 8,2 ay (%95 GA: 6,4, 9,3) ve plasebo artı kemoterapi kolunda 5 aydı (%95 GA: 4,3, 6,2) (HR 0,56; %95 GA: 0.44, 0.70, p<0.0001).
- Genel yanıt oranı immünoterapi kolunda %43 (%95 GA: 38, 49) ve %23 (%95 GA: 16, 30) idi.
En yaygın (≥%15) yan etkiler alopesi (saç dökülmesi), kas-iskelet ağrısı, bulantı, yorgunluk, periferik nöropati (el-ayak uçlarında sinir hasarı) ve iştah azalmasıydı.
Önerilen cemiplimab-rwlc dozu 3 haftada bir 350 mg IV'dir.
*
Aşağıda, daha önce tedavi almamış, ileri evre küçük hücreli dışı akciğer kanseri için en ideal başlangıç tedavilerin karşılaştırması görülebilir.
FDA approves cemiplimab-rwlc in combination with platinum-based chemotherapy for non-small cell lung cancer. fda.gov 11.08.2022






