
PD-L1 yüksek pozitif akciğer kanseri için cemiplimab immünoterapisi FDA onayı aldı
22 Şubat 2021'de FDA (ABD Gıda ve İlaç İdaresi), ileri evre küçük hücreli dışı akciğer kanseri (KHDAK) olan hastaların birinci basamak tedavisi için cemiplimab-rwlc (Libtayo, Regeneron Pharmaceuticals, Inc.) adlı immünoterapiyi onayladı. Kullanım şartı olarak hastalarda EGFR, ALK veya ROS1 genetik mutasyonları olmadan FDA onaylı bir testle belirlendiği üzere tümörleri yüksek PD-L1 pozitifliğine (Tümör Proporsiyon Skoru [TPS] > % 50) sahip olmalı.
Anti-PD-1 sınfından bir immün kontrol noktası inhibitörü olan cemiplimabın etkinliği, ileri evre KHDAK'li 710 hastada çok merkezli, randomize, açık etiketli bir çalışma olan Study 1624'te (NCT03088540) değerlendirilmiştir. Hastalar, 108 haftaya kadar her 3 haftada bir damardan cemiplimab-rwlc 350 mg ya da platin bazlı kemoterapi almak üzere 1:1 oranında iki koldan birine rastgele atandı. Ana etkililik sonuç ölçütleri, körleştirilmiş bağımsız merkezi inceleme başına genel sağkalım (GS) ve progresyonsuz sağkalımdır (PFS).
Çalışma, platin bazlı kemoterapi ile tedavi edilenlere kıyasla cemiplimab-rwlc alan hastalarda GS ve PFS'de istatistiksel olarak önemli gelişmeler olduğunu gösterdi.
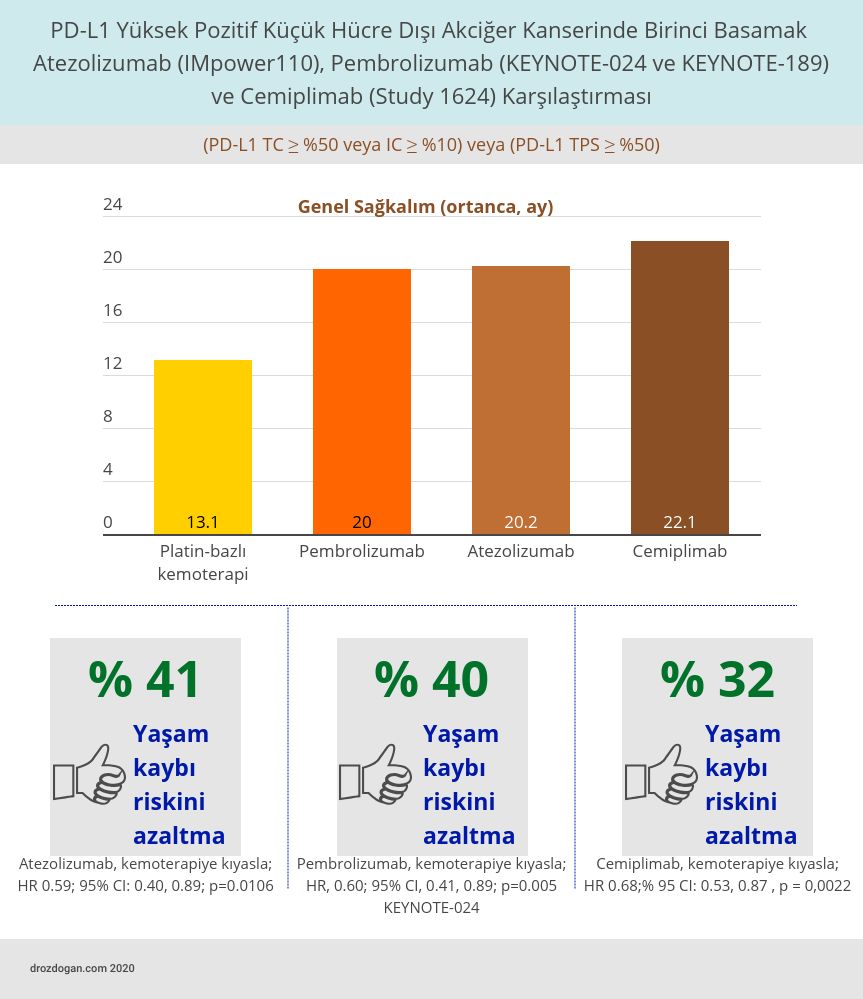
- Ortanca genel sağkalım immünoterapi kolunda 22.1 aydı (% 95 CI: 17.7, NE), kemoterapi kolunda ise 14.3 ay (% 95 CI: 11.7, 19.2)
- Kemoterapi ile karşılaştırıldığında cemiplimab-rwlc kolundaki hastalar için yaşam kaybı riskini azaltma oranı % 32 idi. (HR 0.68;% 95 CI: 0.53, 0.87 , p = 0,0022).
- Ortanca progresyonsuz sağkalım süresi cemiplimab-rwlc kolunda 6,2 ay (4,5, 8,3) ve kemoterapi kolunda 5,6 ay (4,5, 6,1) idi (HR 0,59;% 95 CI: 0,49, 0,72, p <0,0001).
- Cemiplimab-rwlc ve kemoterapi kollarında doğrulanan genel yanıt oranı sırasıyla % 37 (% 95 CI: 32, 42) ve % 21 (% 95 CI: 17, 25) idi.
Study 1624'te tek ajan olarak cemiplimab-rlwc ile en yaygın ( > % 10) yan etkiler kas-iskelet sistemi ağrısı, döküntü, anemi, yorgunluk, iştah azalması, pnömoni (zatürre) ve öksürüktür.
KHDAK tedavisi için önerilen cemiplimab-rwlc dozu 3 haftada bir, 30 dakika boyunca intravenöz olarak 350 mg'dır.
FDA approves cemiplimab-rwlc for non-small cell lung cancer with high PD-L1 expression. 22 Feb 2021 fda.gov






