
Erdafitinib, İleri Evre Mesane Kanseri Tedavisinde Yeni Bir FDA Onayı Aldı
FGFR3 genetik değişiklikleri olan, lokal olarak ilerlemiş veya metastatik ürotelyal karsinomu (idrar yolları kanseri) olan yetişkin hastalar için erdafitinib (Balversa, Janssen Biotech), 19 Ocak 2024'te ABD Gıda ve İlaç İdaresi (FDA) onayı aldı.
Bu yeni onaya göre, erdafitinib tedavisi uygulanacak hastalarda, daha önce uygulanan en az bir basamak sistemik kanser tedavisine rağmen kanserlerinin ilerlemiş olması şartı bulunmaktadır. PD-1 veya PD-L1 immünoterapisine uygun olan ancak bu tedaviyi henüz almamış hastalar için erdafitinib kullanımı tavsiye edilmemektedir. Bu son FDA onayı, 2019 yılında platin bazlı kemoterapiyi takiben FGFR3 veya FGFR2 gen değişiklikleri gösteren metastatik ürotelyal karsinom hastaları için verilen hızlandırılmış onayın kapsamını genişletmektedir ve daha önce belirlenmiş tedavi endikasyonlarını değiştirmektedir.
Erdafitinibin (Balversa) Nedir? Etki Mekanizması Nasıldır?
Erdafitinib, ürotelyal kanser hücrelerinde değişmiş fibroblast büyüme faktörü reseptörlerine (FGFR) yönelik hedefe yönelik bir tedavidir. Normal şartlarda FGFR, hücre dışındaki özgül ligandların (büyüme faktörlerinin) bağlanması ile aktive olur ve hücre içi sinyal yollarını tetikleyerek hücre büyümesi ve çoğalmasını düzenler. Ancak bazı kanser hücrelerinde, FGFR genlerinde meydana gelen değişiklikler (gen amplifikasyonu, kromozomal translokasyon, alternatif sıralama olayları veya nokta mutasyonları gibi) FGFR'nin ligand-bağımsız olarak sürekli aktive olmasına ve kontrolsüz hücre çoğalmasına yol açar.
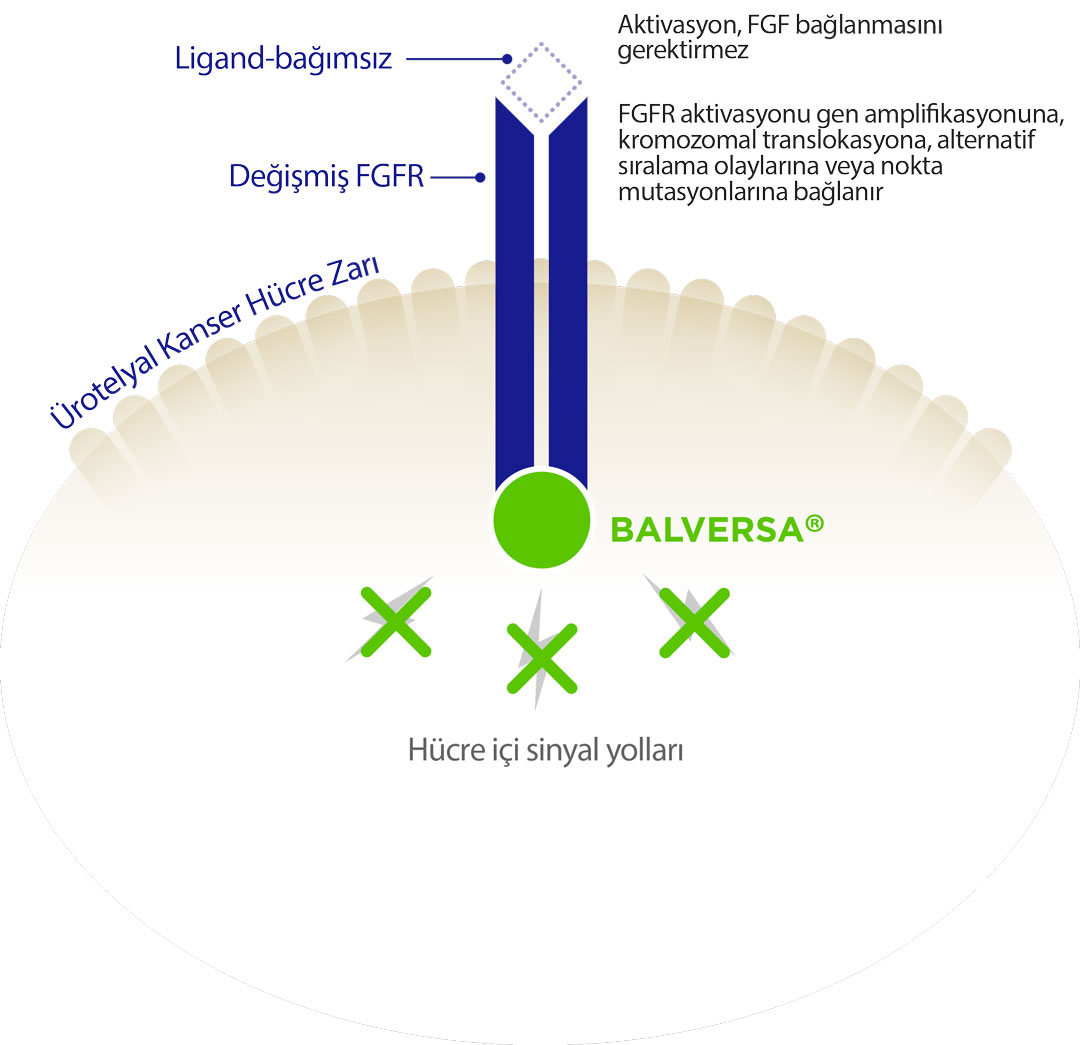
Erdafitinib, bu anormalliğe sahip FGFR'leri hedef alarak, hücre içi sinyal yollarını engeller ve böylece kanser hücrelerinin büyümesini ve yayılmasını baskılar. Görselde gösterilen yeşil daire ile temsil edilen Balversa (erdafitinib), hücre zarındaki değişmiş FGFR'ye bağlanarak sinyal yollarının işleyişini durdurur ve böylece kanser hücrelerinin büyümesi engellenmiş olur.
BLC3001 Çalışması ile Gelen FDA Onayı
2019'da alınan hızlandırılmış onay, ilacın etkililiğini daha sınırlı bir hasta grubunda ve daha az detaylı klinik veri temelinde değerlendirmişti. Yeni onay ise, 266 hastanın katıldığı geniş kapsamlı bir klinik çalışma sonuçlarına dayanıyor.
Yeni onay, BLC3001 Çalışması'nın sonuçlarına dayanıyor. Bu çalışmada, hastalar erdafitinib veya kemoterapi (doketaksel veya vinflunin) alacak şekilde randomize edildi. Çalışma, erdafitinibin OS (genel sağkalım), PFS (ilerlemesiz sağkalım) ve ORR (objektif yanıt oranı) açısından kemoterapiye kıyasla istatistiksel olarak anlamlı iyileşmeler gösterdiğini ortaya koydu.
Erdafitinibin etkililiği, seçilen FGFR3 gen değişikliklerine sahip, daha önce an ez biri immünoterapi olan 1-2 basamak sistemik tedavi almış, 266 metastatik ürotelyal karsinom (mÜK) hastası üzerinde yapılan BLC3001 Çalışması'nın 1. grubunda değerlendirilmiştir.
Bu randomize, açık etiketli deneyde hastalar, erdafitinib veya araştırmacının seçeceği bir kemoterapi (doketaksel veya vinflunin) almak üzere 1:1 oranında rastgele dağıtılmıştır. Randomizasyon, bölge, performans durumu ve visseral (iç organ) veya kemik metastazlarının varlığına göre katmanlandırılmıştır. Hastaların %75'inde FGFR3 gen değişiklikleri, merkezi bir laboratuvarda therascreen FGFR RGQ RT-PCR kit (Qiagen) kullanılarak tespit edilmiştir, geri kalan hastalarda ise yerel sonraki nesil dizileme testleri kullanılmıştır.
Başlıca etkililik sonucu ölçütü, genel sağ kalım (OS) olmuştur. Araştırmacı tarafından değerlendirilen ilerlemesiz sağ kalım (PFS) ve objektif yanıt oranı (ORR) ise diğer sonuç ölçütleri arasındadır.
Erdafitinibin OS, PFS ve ORR'da kemoterapiye kıyasla istatistiksel olarak anlamlı iyileşmeler gösterdiği tespit edilmiştir.
Sonuçlar
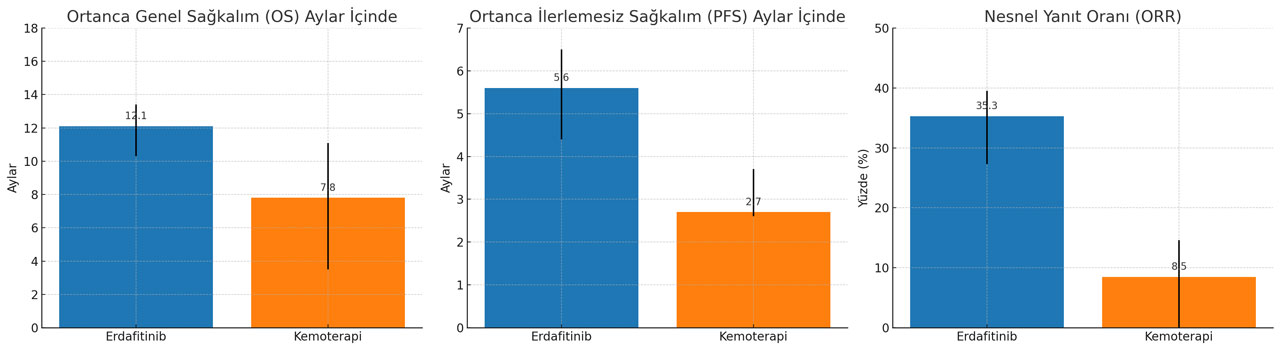
- Erdafitinib alan hastaların medyan OS süresi 12.1 ay (yüzde 95 güven aralığı: 10.3, 16.4) iken, kemoterapi alanlarda bu süre 7.8 aydır (yüzde 95 güven aralığı: 6.5, 11.1) (tehlike oranı [HR] 0.64 [yüzde 95 güven aralığı: 0.47, 0.88]; p-değeri=0.0050).
- Erdafitinib alan hastaların medyan PFS süresi 5.6 ay (yüzde 95 güven aralığı: 4.4, 5.7), kemoterapi alanlarda ise 2.7 aydır (yüzde 95 güven aralığı: 1.8, 3.7) (HR 0.58 [yüzde 95 güven aralığı: 0.44, 0.78]; p-değeri=0.0002).
- Erdafitinib alan hastaların onaylanmış ORR'si %35.3 (yüzde 95 güven aralığı: 27.3, 43.9), kemoterapi alanlarda ise %8.5'tir (yüzde 95 güven aralığı: 4.3, 14.6) (p-değeri<0.001).
En yaygın (> %20) yan etkiler ve laboratuvar anormallikleri arasında artmış fosfat, tırnak bozuklukları, ishal, stomatit, artmış alkalen fosfataz, azalmış hemoglobin, artmış alanin aminotransferaz, artmış aspartat aminotransferaz, azalmış sodyum, artmış kreatinin, kuru ağız, azalmış fosfat, avuç içi-ayak tabanı eritrodistezi sendromu, disgeuzi, yorgunluk, kuru cilt, kabızlık, iştah azalması, artmış kalsiyum, alopesi, kuru göz, artmış potasyum ve azalmış kilo yer almaktadır.
Önerilen erdafitinib dozu, günde bir kez ağız yoluyla alınan 8 mg'dır ve tolerabiliteye bağlı olarak, hiperfosfatemi de dahil olmak üzere, 14 ila 21 gün içinde dozu günde bir kez 9 mg'a çıkarılabilir. Tedavi, hastalığın ilerlemesi veya kabul edilemez toksisiteye kadar devam etmelidir.
FDA approves erdafitinib for locally advanced or metastatic urothelial carcinoma. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-erdafitinib-locally-advanced-or-metastatic-urothelial-carcinoma 19 jan 2024






