Erken Evre Meme Kanseri Ameliyat Sonrası Koruyucu Tedavi için Olaparib FDA Onayı Aldı
Patojenik (zararlı) veya patojenik olduğundan şüphelenilen germ hattı (kalıtsal) BRCA mutasyonlu (gBRCAm) ve insan epidermal büyüme faktörü reseptörü 2 (HER2) negatif olan, neoadjuvan veya adjuvan kemoterapi ile tedavi edilmiş yüksek riskli meme kanserli hastaların ameliyat sonrası adjuvan (koruyucu) tedavisi için olaparib (Lynparza, AstraZeneca) adlı ilaç, 11 Mart 2022'de FDA onayı aldı.
Olaparib, yeni nesil kanser ilaçlarından biridir, PARP inhibitörü sınıfındandır ve ilk FDA onayını 2017 yılında over kanserinde aldı. Daha sonra 2018 yılında 4. evre, kalıtsal BRCA mutasyonu pozitif meme kanserinde onay aldı. Sonra 2018'de BRCA mutant over kanseri birinci basamak idame tedavisinde, 2019'da BRCA mutant metastatik pankreas kanseri birinci basamak idame tedavisinde, 2020'de HRD-pozitif ileri evre over kanseri birinci basamak idame tedavisinde bevasizumab ile birlikte ve yine 2020'de HRR gene mutasyonlu metastatik kastrasyona dirençli prostat kanserinde FDA onayı almıştı.
Aralık 2022 Güncellemesi: 3,5 yıllık daha uzun takip ile, adjuvan olaparib, bir genel sağkalım yararı da gösterdi (4 yıllık genel sağkalım yüzde 90'a karşı yüzde 86). Bu verilere dayanarak, OlympiA çalışmasından alınan yüksek risk kriterlerini karşılayan erken evre HER2-negatif meme kanseri olan BRCA taşıyıcıları için, bir yıl boyunca günde iki kez ağızdan adjuvan olaparib öneriyoruz.
OlympiA Çalışmasına Göre Yüksek Risk Kriterleri
|
Üçlü negatif meme kanseri (hastaların %82'si) |
|
|
Hormon reseptörü pozitif meme kanseri (hastaların %18'i) |
|
pTY: patolojik tam yanıt.
OlympiA Çalışması ile Gelen FDA onayı
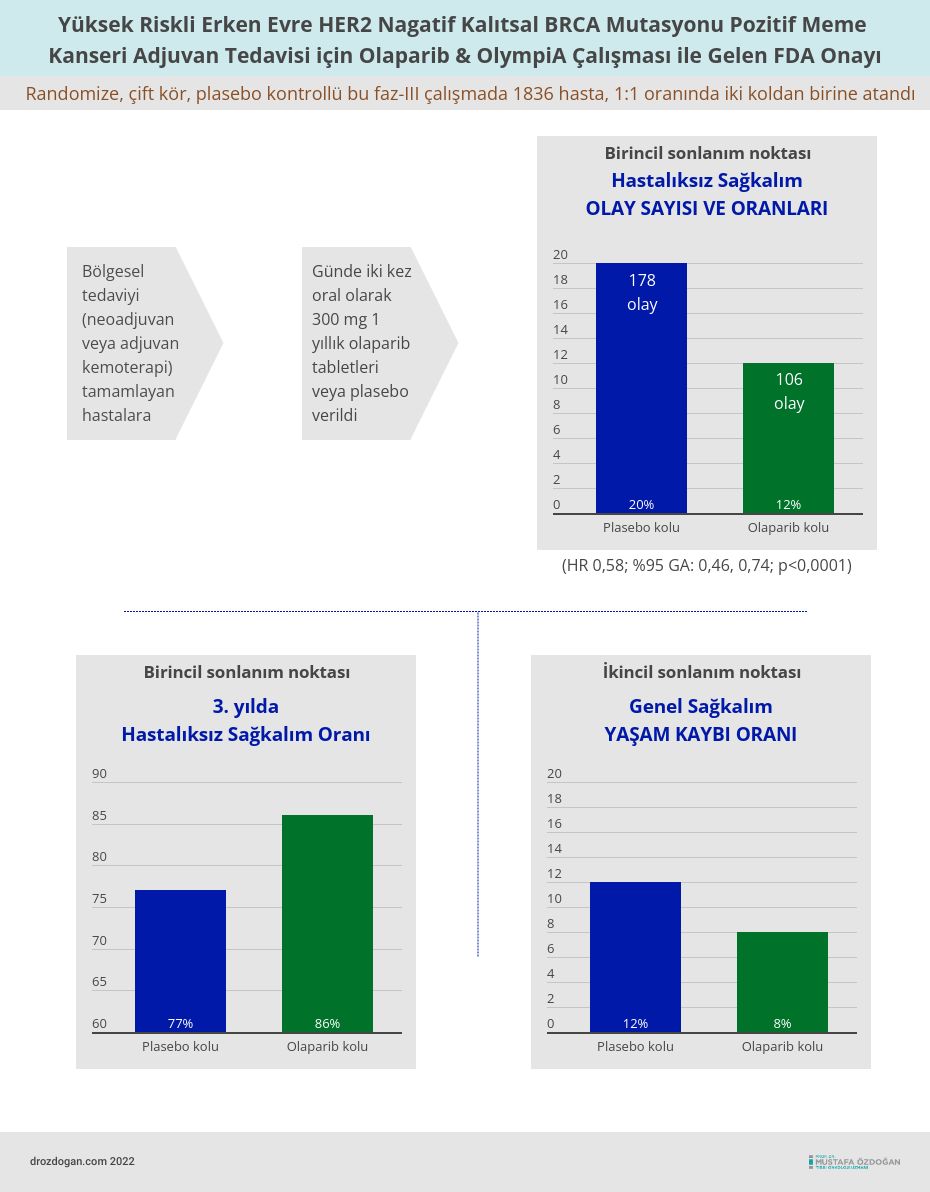
FDA onayı, bölgesel tedaviyi (neoadjuvan veya adjuvan kemoterapi) tamamlayan gBRCAm HER2 negatif yüksek riskli erken meme kanserli 1836 hastanın katıldığı randomize (1:1), çift kör, plasebo kontrollü, uluslararası bir çalışma olan OlympiA'ya dayanmaktadır.
Hastalar, günde iki kez oral olarak 300 mg 1 yıllık olaparib tabletleri veya plasebo alacak şekilde randomize edildi.
Hastaların antrasiklinler, taksanlar veya her ikisini birden içeren en az 6 kür neoadjuvan veya adjuvan kemoterapiyi tamamlamaları gerekiyordu.
Hormon reseptörü pozitif meme kanseri olan hastaların, yerel kılavuzlara göre endokrin tedavisi ile eşzamanlı tedaviye devam etmelerine izin verildi.
Çalışmada hedeflenen birincil etkinlik sonlanım noktası, çalışma başında ilk nüks (kanser tekrarı) tarihine kadar geçen süre olarak tanımlanan hastalıksız sağkalımdır.
İlk nüks: lokal-bölgesel kanser tekrarı, uzak metastaz, karşı memede kanser, yeni kanser veya herhangi bir nedenden yaşam kaybı olarak tanımlandı.
Sonuçlar
- Hastalıksız sağkalım için olaparib kolunda 106 olay (%12) ve plasebo kolunda 178 olay (%20) vardı (HR 0,58; %95 GA: 0,46, 0,74; p<0,0001).
- 3. yılda hastalıksız sağkalım, olaparib alan hastalar için %86 (%95 GA: 82.8, 88.4) ve plasebo alanlar için %77 (%95 GA: 73.7, 80.1) idi.
- Ek bir etkinlik son noktası, genel sağkalımdı. Olaparib kolunda 75 yaşam kaybı (%8) ve plasebo kolunda 109 yaşam kaybı (%12) vardı (HR 0.68; %95 GA: 0.50, 0.91; p=0.0091).
OlympiA çalışmasında en yaygın (≥%10) yan etkiler, bulantı, yorgunluk (asteni dahil), anemi, kusma, baş ağrısı, diyare, lökopeni, nötropeni, iştah azalması, tat alma bozukluğu, baş dönmesi ve stomatittir.
Önerilen olaparib dozu, bir yıla kadar, aç veya tok karnına günde iki kez ağızdan alınan 300 mg'dır.
1. FDA approves olaparib for adjuvant treatment of high-risk early breast cancer. fda.gov 11 Mar
2. Geyer CE Jr, Garber JE, Gelber RD, et al. Overall survival in the OlympiA phase III trial of adjuvant olaparib in patients with germline pathogenic variants in BRCA1/2 and high-risk, early breast cancer. Ann Oncol 2022; 33:1250.