
Evre IIB-C Melanom için Nivolumab İmmünoterapisi FDA Onayı Aldı
Ameliyatla tamamen çıkarılmış evre IIB ve evre IIC melanomun adjuvan (ameliyat sonrası kanserin tekrar etme riskini azaltıcı) tedavisi için nivolumab (Opdivo, Bristol-Myers Squibb) isimli immünoterapi, 13 Ekim 2023'te FDA (ABD Gıda ve İlaç İdaresi) onayı aldı.
Bu gelişme, bu durumdaki hastaların adjuvan tedavisi için ikinci FDA onayını temsil etmektedir. Pembrolizumab (Keytruda), aynı endikasyon için 2021 yılında FDA tarafından onaylanmıştı.
Evre IIB/C Melanom Ne Anlama Gelir?
Melanom, deri kanserlerinin %5'ini oluşturan agresif türüdür. Melanom evrelemesi, hastalığın ne kadar ilerlediğini anlamak için kullanılır. Evre IIB ve IIC, melanomun erken evrelerinden daha ileri bir aşamayı temsil eder, ancak henüz uzak organlara yayılmamıştır.
Evre IIB Melanom
- Tümör kalınlığı genellikle 2.01–4.0 mm arasındadır.
- Ülserasyon (yüzeyde açık yara) yoktur veya minimaldır.
- Tümör lokal (yerel) olarak büyümüştür, ancak henüz lenf nodlarına veya uzak organlara yayılmamıştır.
Evre IIC Melanom
- Tümör kalınlığı 4.0 mm veya daha fazladır.
- Ülserasyon genellikle belirgindir.
- Yine, hastalık lokal olarak büyümüştür ve lenf nodlarına veya uzak organlara yayılmamıştır.
CHECKMATE-76K Çalışması ile Gelen FDA Onayı
Evre IIB ve IIC'de nivolumabın etkinliği, CHECKMATE-76K (NCT04099251) adlı randomize, çift-kör bir klinik çalışma ile değerlendirildi.
Bu çalışmaya 790 evre IIB/C melanom hastası katıldı.
Hastalar, 4 haftada bir intravenöz 480 mg nivolumab veya plasebo, hastalık tekrarı ya da kabul edilemez toksisite görülünceye veya en fazla 1 yıl boyunca, 2:1 oranında randomize edildi.
Katılım için, ana melanomun tamamen çıkarılmış olması, negatif cerrahi sınırlar ve 12 hafta öncesine kadar negatif sentinel lenf nodu gerekmekteydi. Ayrıca, ECOG performans durumu 0 veya 1 olmalıydı.
Ocular/uveal veya mukozal melanom, otoimmün hastalığı olanlar; kortikosteroid veya diğer immünsüpresif ilaçlarla sistemik tedavi gereksinimi olanlar; ve daha önce melanom tedavisi görmüş olanlar (cerrahi dışında) çalışmaya alınmadı.
Sonuçlar
Ana etkinlik sonuç ölçümü, hastalık tekrarı (yerel, bölgesel veya uzak metastaz), yeni primer melanom veya herhangi bir nedenle yaşam kaybı olmak üzere ilk olayın gerçekleştiği zamana kadar olan süre olarak tanımlanan rekürrenssiz sağkalım idi.
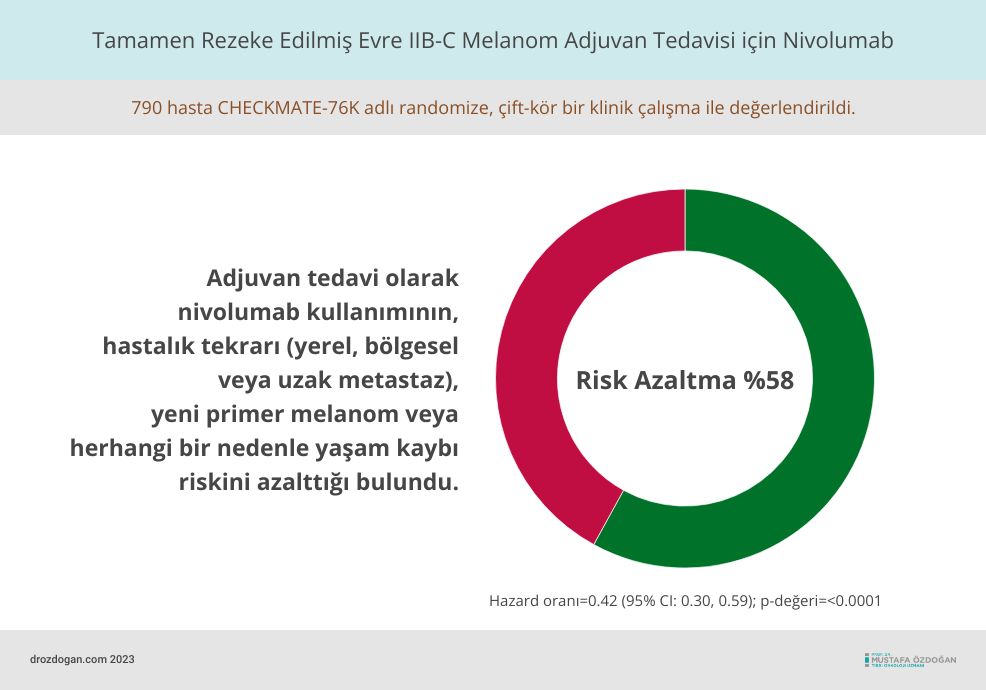
Ortanca rekürrensiz sağkalım süresine hem nivolumab kolunda (95% CI: 28.5, ulaşılamamış) hem de plasebo kolunda (95% CI: 21.6, ulaşılamamış) ulaşılamamıştır, bununla birlikte nivolumab kullanımının, kanser tekrarı veya yaşam kaybı riskini %58 azalttığı bulundu (hazard oranı=0.42 [95% CI: 0.30, 0.59]; p-değeri=<0.0001).
En Sık Görülen Yan Etkiler
En sık (%20 ve üzeri hastalarda) görülen yan etkiler yorgunluk, kas-iskelet sistemi ağrıları, döküntü, ishal ve kaşıntı idi.
Önerilen Dozaj
40 kg veya daha fazla ağırlığındaki hastalar için önerilen nivolumab dozu, hastalık ilerlemesi veya kabul edilemez toksisite görülünceye kadar 2 haftada bir 240 mg veya 4 haftada bir 480 mg'dır. 40 kg'dan daha az ağırlığındaki pediyatrik hastalar için önerilen doz, hastalık ilerlemesi veya kabul edilemez toksisite görülünceye kadar 2 haftada bir 3 mg/kg veya 4 haftada bir 6 mg/kg'dır.
Uluslararası İş Birliği ve İnceleme
Bu inceleme, FDA Onkoloji Merkezi'nin bir inisiyatifi olan Project Orbis altında gerçekleştirildi. Project Orbis, onkoloji ilaçlarının uluslararası ortaklar arasında eş zamanlı sunulması ve incelenmesi için bir çerçeve sağlar. Bu inceleme için FDA, Avustralya Terapötik Mallar İdaresi (TGA), Health Canada, İsrail Sağlık Bakanlığı (IMoH) ve İsviçre'nin Swissmedic ile işbirliği yaptı. Diğer düzenleyici kurumların incelemeleri devam etmektedir.
Evre IIB ve IIC Melanom Adjuvan Tedavisinde Opdivo ve Keytruda Karşılaştırması
Etkinlik oranları:
- Nivolumab CHECKMATE-76K çalışmasıyla onay aldı ve nüks riskini %58 azalttı.
- Pembrolizumab KEYNOTE-716 çalışmasıyla onay aldı ve nüks riskini %35 azalttı.
FDA approves nivolumab for adjuvant treatment of Stage IIB/C melanoma. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-nivolumab-adjuvant-treatment-stage-iibc-melanoma 18 Oct 2023






