
İmatinib (Glivec) Nedir? FDA Onayı, Türkiye Ruhsatı ve Geri Ödeme Durumu
- FDA Onaylı: Evet (İlk onay tarihi: 10 Mayıs 2001)
- Kutu Adı ve Üretici, Türkiye Dağıtımı: İlk orijinal molekül kutu adı Glivec (Novartis), ayrıca farklı jenerik isimlerle de bulunmaktadır; Gliotin (Abdi İbrahim), Glivon (Nobel İlaç), İmagliv (Saba İlaç), İmatenil (Logus İlaç), İmavec (Koçak Farma), İmatis (Deva Holding), Maxinib (Centurion Pharma).
- Etken Madde Adı: İmatinib
- Uygulama Şekli: Oral, tablet formu
- Sınıfı: Sinyal Transdüksiyon İnhibitörü, BCR-ABL İnhibitörü
- Kategori: Hedefe Yönelik Ajan
- Onaylı Olduğu Kanserler:
- Kronik Miyeloid Lösemi (KML),
- Philadelphia kromozomu pozitif akut lenfoblastik lösemi (Ph+ ALL),
- Gastrointestinal Stromal Tümörler (GIST),
- diğer ilgili maligniteler.
İmatinib Nedir?
İmatinib, öncelikle BCR-ABL tirozin kinaz enzimini hedefleyen ve hücre içi sinyal iletim yollarını inhibe ederek kanser hücrelerinin büyümesini ve çoğalmasını durduran küçük molekül yapıda bir kanser ilacıdır. Ayrıca, PDGFR ve c-KIT gibi diğer tirozin kinaz reseptörlerini inhibe etmesi sayesinde gastrointestinal stromal tümörler, kronik miyeloid lösemi (KML) ve Philadelphia kromozomu pozitif lösemi gibi hastalıklarda etkilidir.
İnsanlık Tarihindeki En Büyük Başarı Hikayelerinden Biri
2001 yılında FDA onayı alan imatinib (Glivec), modern kanser tedavisinde adeta bir dönüm noktası oldu. KML ve GIST gibi hastalıklarda hedefe yönelik tedavinin mümkün olduğunu kanıtlayan bu ilaç, biyolojiyi hedef alan akıllı tedavi çağına öncülük etti. Özellikle KML tedavisinde, hastaların yaşam sürelerini ve kalitelerini çarpıcı bir şekilde artırmasıyla bilim dünyasında geniş yankı uyandırdı.
İmatinibin başarısı, yalnızca onkoloji alanında değil, tıbbi araştırma yöntemlerinde de devrim yarattı. Geleneksel olarak kemoterapi, hızlı bölünen hücreleri hedef alırken, İmatinib yalnızca hastalığa neden olan belirli moleküler mekanizmaları hedef alarak hem etkinliği artırdı hem de yan etkileri azalttı. Bu yaklaşım, kanser tedavisinde daha az toksik ve daha etkili ilaçların geliştirilmesi için bir prototip oluşturdu.
Bu büyük bilimsel başarı, yalnızca sağlık otoritelerinin değil, medyanın ve toplumun da ilgisini çekti. Time dergisi, 28 Mayıs 2001 tarihli sayısında imatinibi "Kanser Tedavisinde Çığır Açan Yenilik" başlığıyla kapağına taşıdı. Bu kapak, bir ilaç için alışılmadık bir ilgi göstergesi olup, imatinibin onkolojideki devrimsel etkisinin küresel ölçekte tanınmasını sağladı. Kapakta, imatinibin geliştirilmesini "kanser tedavisinde bilimsel bir mucize" olarak nitelendiren ifadeler yer aldı.

Tarihi Bağlam ve İnsanlığa Etkisi
20. yüzyılın sonlarına doğru, kanser biyolojisinin moleküler temelleri daha iyi anlaşılmaya başlanmıştı. İmatinib, 1990'ların sonlarında biyokimyacı Nicholas Lyndon tarafından keşfedilmiş ve onkolog Dr. Brian Druker öncülüğündeki ekip tarafından, KML hastalarında görülen BCR-ABL füzyon proteinini inhibe etmek üzere klinik araştırmalarda denenemiştir. Bu protein, anormal hücre büyümesine neden olan sürekli aktif bir tirozin kinazdı. İmatinib, bu enzimi seçici olarak hedef alarak, kanserin moleküler temellerine saldıran ilk ilaçlardan biri oldu.
FDA onayı sonrasında sadece birkaç yıl içinde, ölümcül bir hastalık olarak görülen KML, kronik bir hastalık haline geldi. Bu başarı, araştırmacılara ve doktorlara, diğer kanser türlerinde de benzer hedefe yönelik tedavilerin geliştirilebileceği konusunda umut verdi.
İmatinib Etki Mekanizması Nasıldır?
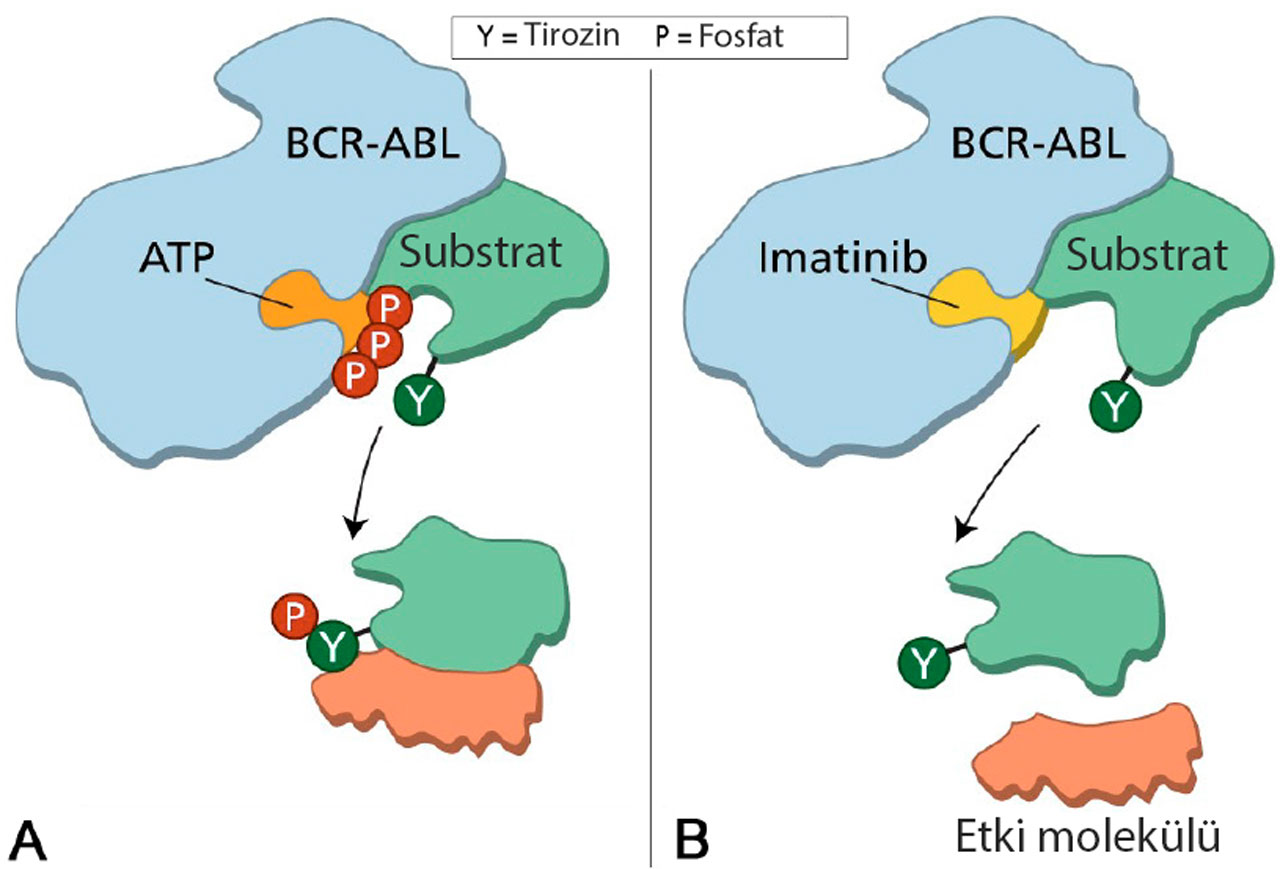
Yukarıdaki görsel, BCR-ABL proteininin normal işlevini ve imatinibin bu proteinin aktivitesini nasıl engellediğini basitçe açıklamaktadır:
Sol Panel (A): Normal BCR-ABL Aktivitesi
- BCR-ABL proteini, bir tirozin kinazdır. Bu, ATP (adenozin trifosfat) kullanarak tirozin içeren substratları fosforile eden (fosfat ekleyen) bir enzimdir.
- ATP, proteine bağlanır ve substrat üzerine fosfat grupları eklenir. Bu fosforilasyon işlemi, hücre içi sinyal yollarını aktive ederek hücre büyümesini ve çoğalmasını tetikler.
- BCR-ABL'nin sürekli aktif olması, kanser hücrelerinin kontrolsüz bir şekilde çoğalmasına neden olur.
Sağ Panel (B): İmatinibin Etkisi
- İmatinib, BCR-ABL proteininin ATP bağlanma bölgesine bağlanarak ATP'nin bu bölgeye ulaşmasını engeller.
- ATP'nin bağlanamaması, fosforilasyon işlemini durdurur. Bu da substratın fosforillenmesini ve ardından hücre içi sinyal yollarının aktive olmasını önler.
- Sonuç olarak, hücre büyümesi ve çoğalması engellenir, kanser hücreleri ölür veya çoğalmayı durdurur.
Bu mekanizma, İmatinib'in özellikle kronik miyeloid lösemi (KML) gibi kanser türlerinde son derece etkili olmasını sağlayan temel prensiptir.
İmatinibin diğer etki mekanizmaları şunlardır:
- Apoptoz (Hücre Ölümü) İndüksiyonu:
- İmatinib, BCR-ABL pozitif olan kanser hücrelerini öldürür, ancak bu hücrelerde farklılaşma yapmaz.
- PDGFR ve c-Kit Reseptörlerinin İnhibisyonu:
- İmatinib, kanser hücrelerinin büyümesini sağlayan platelet kaynaklı büyüme faktörü reseptörlerini (PDGFR) ve c-Kit’i inhibe ederek tümör büyümesini durdurur.
- Diğer Tirozin Kinazların İnhibisyonu:
- BCR-ABL dışında P185 gibi diğer aktif tirozin kinazları da etkili bir şekilde durdurur, böylece kanserin büyümesini daha geniş bir şekilde engeller.
FDA (ABD Gıda ve İlaç İdaresi) Onay Tarihçesi
- 10 Mayıs 2001: Kronik miyeloid lösemi (KML) tedavisi için onaylandı.
- 2002: Gastrointestinal stromal tümörlerin (GIST) tedavisi için onay aldı.
- 2006: Dermatofibrosarkoma protuberans (DFSP) tedavisi için onaylandı.
- 25 Ocak 2013: Philadelphia kromozomu pozitif akut lenfoblastik lösemi (Ph+ ALL) olan çocuk hastaların tedavisi için onay aldı.
- 22 Kasım 2024: İmatinibin oral çözelti formu olan Imkeldi, çeşitli kanserlerin tedavisi için onaylandı.
Türkiye Ruhsatı ve Terapötik Endikasyonlar
- Birinci basamak tedavi olarak kemik iliği transplantasyonunun düşünülmediği, yeni tanı konmuş Philadelphia kromozomu (BCR-ABL) pozitif (Ph+) kronik miyeloid lösemi (KML) olan erişkin ve pediyatrik hastalar.
- İnterferon-alfa tedavisinin başarısızlığından sonra kronik faz Ph+ KML’si olan erişkin ya da pediyatrik hastalar, akselere faz, ya da blast krizindeki Ph+ KML-si olan erişkin ya da pediyatrik hastalar.
- Yeni tanı konulan Philadelphia kromozomu pozitif akut lenfoblastik lösemili (Ph+ ALL) erişkin ve pediyatrik hastalarda, kemoterapi ile entegre.
- Nüks eden veya dirençli Ph+ ALL-li erişkin hastalarda monoterapi olarak.
- Trombosit kaynaklı büyüme faktörü reseptörü (PDGFR) geni yeniden düzenlemeleri ile ilişkili miyelodisplastik/miyeloproliferatif hastalıkları (MDS/MPD) olan erişkin hastalar.
- İleri derecede hipereozinofilik sendrom (HES) ve/veya FIP1L1-PDGFRα yeniden düzenlemesi olan kronik eozinofilik lösemi (CEL) olan erişkin hastalar. GLİVEC’in kemik iliği naklinin sonucu üzerindeki etkisi belirlenmemiştir.
- Kit (CD 117) pozitif rezeke edilemeyen ve/veya metastatik malign gastrointestinal stromal tümörleri (GIST) olan erişkin hastaların tedavisi. Opere edilmiş, C-KIT reseptörü pozitif bulunan erişkin GIST (gastrointestinal stromal tümör) hastalarında AFIP (*) kriterlerine göre yüksek risk taşıyanlarda veya tümör perforasyonu olanlarda adjuvan tedavide üç yıl süre ile,
- Rezeke edilemeyen dermatofibrosarkoma protuberanslı (DFSP) erişkin hastaların ve cerrahi için uygun olmayan tekrarlayan ve/veya metastatik DFSP’li erişkin hastaların tedavisi. Erişkin ve pediyatrik hastalarda GLİVEC’in etkililiği, KML’de genel hematolojik ve sitogenetik yanıt oranlarına ve progresyonsuz sağkalıma, Ph+ ALL, MDS/MPD-de hematolojik ve sitogenetik yanıt oranlarında, HES/CEL-de hematolojik yanıt oranlarında ve rezeke edilemeyen ve/veya metastatik GIST ve DFSP-li erişkin hastalarda objektif yanıt oranları ve adjuvan GIST-te nükssüz sağkalıma dayanmaktadır. PDGFR gen yeniden düzenlemeleri ile ilişkili MDS/MPD hastalarında imatinib ile deneyim çok sınırlıdır. Yeni tanı konulan kronik faz KML dışında, bu hastalıklar için klinik bir fayda veya sağkalımın arttığını gösteren herhangi bir kontrollü çalışma yoktur.
(*) AFIP kriterlerine göre yüksek riskli grupların tanımı;
- Mide yerleşimli alanlarda tümör büyüklüğü 6 cm-nin üzerinde olan ve mitotik indeksi 5’in üzerinde bulunanlar
- Mide dışındaki yerleşimlerde 10 cm ve üzerinde tümör büyüklüğü olan ya da mitotik indeksi 5-in üzerinde bulunanlar
İmatinib Geri Ödemesi Var mı?
İmatinibin Sosyal Güvenlik Kurumu (SGK) tarafından geri ödeme kapsamına alındığı tedavi durumları şu şekildedir;
- Kronik miyeloid lösemi (KML), akut lenfoblastik lösemi (ALL), rezeke edilemeyen ve/veya metastatik malign gastrointestinal stromal tümörleri (GIST) tanılarında kısa ürün bilgisine uygun şekilde geri ödeme kapsamındadır.
Fiyatı: Aralık 2024 itibarıyla Glivec (ilk orijinal molekül) 100 mg 120 tablet eczane satış fiyatı 16.415 ₺ ve 400 mg 30 tablet fiyatı 14.847 ₺
TİTCK Ek Onayı Alınmadan Kullanılabilecek Endikasyon Dışı İlaç Listesi İçinde İmatinib için Durum Nedir?
- İleri Evre Kordoma:
- Radyoterapi veya cerrahiye uygun olmayan hastalarda 1. basamakta kullanımı uygundur.
- İleri Evre Desmoid Tümör (Agresif Fibromatozis):
- Lokal tedaviye uygun olmayan hastalarda kullanımı uygundur.
- İleri Evre Tenosinoviyal Dev Hücreli Tümör / Pigmente Villonodüler Sinovit:
- İkinci basamakta ve sonrasında kullanımı uygundur.
- Mukozal Malign Melanom:
- c-KIT mutasyonu olan hastalarda 2. basamak ve sonrasında kullanımı uygundur. c-KIT amplifikasyonu veya immünohistokimyasal olarak gösterilen c-KIT pozitifliği, c-KIT mutasyonu olarak kabul edilemez.
Direnç Mekanizması
- BCR-ABL Tirozin Kinazının İfadesinin Artışı:
- BCR-ABL geninin amplifikasyonu yoluyla tirozin kinaz miktarında artış meydana gelir, bu da ilaca karşı direncin gelişmesine neden olur.
- BCR-ABL Tirozin Kinazındaki Mutasyonlar:
- BCR-ABL tirozin kinazında meydana gelen mutasyonlar, ilacın bağlanma bölgesindeki afinitesini azaltarak ilaca karşı direnci artırır.
- P170 Glikoproteinin İfadesinin Artışı:
- Bu protein, hücre dışına ilaç taşınmasını artırarak hücre içindeki ilacın etkinliğini azaltır.
- İlacın Artan Yıkımı veya Metabolizması:
- Henüz tam olarak tanımlanamayan mekanizmalar yoluyla ilacın metabolizması veya hücre içinde yıkımı artar.
- c-Kit İfadesinin Artışı:
- c-Kit geninin amplifikasyonu, tirozin kinaz seviyelerinde artışa neden olur.
- c-Kit Tirozin Kinazında Mutasyonlar:
- c-Kit tirozin kinazında meydana gelen mutasyonlar, ilacın bu proteine bağlanma yeteneğini azaltarak dirence neden olur.
Farmakokinetik Özellikleri
- Emilim
- İmatinibin oral biyoyararlanımı yaklaşık %100-dür. İlaç ağız yoluyla alındığında hızla emilir ve maksimum plazma konsantrasyonuna genellikle 2-3 saat içinde ulaşılır.
- Dağılım
- İmatinib, plazma proteinlerine yüksek oranda (%95) bağlanır; bu bağlanma başlıca albümin ve α1-asid glikoprotein aracılığıyla gerçekleşir. İlacın sabit durumdaki konsantrasyonlarına 2-3 gün içinde ulaşılır.
- Metabolizma
- İmatinib, esas olarak karaciğerde CYP3A4 mikrozomal enzimleri tarafından metabolize edilir. Diğer sitokrom P450 enzimleri, ilacın metabolizmasında yalnızca küçük bir rol oynar.
- Ana Metabolit: N-demetillenmiş piperazin türevi, ana ilacın in vitro etkinliğine benzer bir etkinlik gösterir.
- Eliminasyon: İlacın büyük bir kısmı dışkı yoluyla, çoğunlukla metabolitler olarak atılır.
- Yarı Ömür: Ana ilacın terminal yarı ömrü yaklaşık 18 saattir. Ana metabolitin (N-desmetil türevi) yarı ömrü ise yaklaşık 40 saattir.
- İmatinib, esas olarak karaciğerde CYP3A4 mikrozomal enzimleri tarafından metabolize edilir. Diğer sitokrom P450 enzimleri, ilacın metabolizmasında yalnızca küçük bir rol oynar.
Bu farmakokinetik özellikler, İmatinibin plazmada istikrarlı bir konsantrasyona ulaşmasını sağlar ve ilaç dozlamasında esneklik sunar.
Doz Aralığı
- Kronik Faz KML:
- Başlangıç dozu günde 400 mg-dır. Aşağıdaki durumlarda doz artırımı 400 mg-dan 600 mg-a veya maksimum 800 mg-a (günde iki kez 400 mg) kadar düşünülebilir:
- Hastalık progresyonu (herhangi bir zamanda),
- En az 3 aylık tedaviye rağmen yeterli hematolojik yanıt alınamaması,
- 12 aylık tedavi sonunda sitogenetik yanıt alınamaması,
- Daha önce elde edilen hematolojik ve/veya sitogenetik yanıtın kaybı.
- Doz artırımı sonrası yan etkilerin artabileceği göz önüne alınarak hastaların yakından izlenmesi gereklidir.
- Başlangıç dozu günde 400 mg-dır. Aşağıdaki durumlarda doz artırımı 400 mg-dan 600 mg-a veya maksimum 800 mg-a (günde iki kez 400 mg) kadar düşünülebilir:
- Hızlanmış Faz veya Blast Krizindeki KML:
- Başlangıç dozu günde 600 mg-dır. Gerekirse doz 800 mg-a kadar (günde iki kez 400 mg) artırılabilir.
- Gastrointestinal Stromal Tümörler (GIST):
- Ameliyat edilemeyen/metastatik GIST: Başlangıç dozu günde 400 mg-dır. Hastalık ilerlemesi durumunda doz 600 mg veya 800 mg-a kadar artırılabilir.
- Erken evre GIST: Cerrahi sonrası adjuvan tedavi için önerilen doz, günde 400 mg-dır ve bu tedavi 3 yıl süreyle uygulanır.
- Myelodisplastik/Myeloproliferatif Hastalıklar (MDS/MPD):
- Başlangıç dozu günde 400 mg-dır.
- Hipereozinofilik Sendrom/Kronik Eozinofilik Lösemi (HES/CEL):
- Başlangıç dozu günde 400 mg-dır.
- Philadelphia Kromozomu Pozitif Akut Lenfoblastik Lösemi (Ph+ ALL):
- Başlangıç dozu günde 600 mg-dır.
- Doz Ayarlamaları:
- Yüksek Doz Gereksinimi:
- Doz artırımı, tolere edilemeyen toksisite veya ağır yan etkiler olmadığı sürece yapılabilir.
- Böbrek veya Karaciğer Yetmezliği:
- Orta veya ciddi yetmezliği olan hastalarda doz azaltılmalıdır (örneğin, hafif karaciğer yetmezliğinde önerilen doz %75-e kadar azaltılabilir).
- Yüksek Doz Gereksinimi:
Bu dozlar, tedavi süresince hastanın klinik yanıtı ve toleransına göre hekim tarafından ayarlanabilir.
İlaç Etkileşimleri
- Fenitoin ve Diğer CYP3A4 Enzim İndükleyicileri:
- Fenitoin, karbamazepin, rifampin, fenobarbital ve St. John’s Wort gibi karaciğerde CYP3A4 enzimini uyaran ilaçlar, İmatinibin metabolizmasını artırarak ilacın inaktivasyonuna ve daha düşük etkili ilaç seviyelerine yol açar.
- CYP3A4 Enzim İnhibitörleri:
- Ketokonazol, itrakonazol, eritromisin ve klaritromisin gibi CYP3A4 enzimini inhibe eden ilaçlar, İmatinibin metabolizmasını azaltır. Bu durum, ilaç düzeylerinin artmasına ve potansiyel toksisite riskinin yükselmesine neden olabilir.
- Warfarin:
- Warfarin kullanan hastalarda İmatinib, karaciğerdeki P450 sistemi yoluyla warfarin metabolizmasını inhibe eder. Bu durum, protrombin zamanı (PT) ve uluslararası normalize oranında (INR) değişikliklere veya kanama riskinde artışa yol açabilir. İmatenib tedavisi sırasında warfarin kullanan hastaların pıhtılaşma parametreleri (PT ve INR) yakından izlenmelidir. Gerekirse warfarin dozunda dikkatli ayarlama yapılmalıdır.
Dikkat Edilmesi Gereken Durumlar
- Hastalar düzenli olarak tartılmalı ve sıvı tutulumu belirtileri açısından izlenmelidir:
- Sıvı tutulumu ve ödem riski, daha yüksek ilaç dozlarında ve 65 yaş üzerindeki hastalarda artar.
- Karaciğer Yetmezliği:
- Hafif veya orta dereceli karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği olan hastalarda önerilen başlangıç dozunda %25 azalma yapılmalıdır.
- Böbrek Yetmezliği:
- Orta dereceli böbrek yetmezliği olan (kreatinin klerensi 20–39 mL/dak) hastalarda, 400 mg’ı aşan dozlar önerilmez ve başlangıç dozu %50 azaltılmalıdır. Hafif böbrek yetmezliği olan (kreatinin klerensi 40–59 mL/dak) hastalarda 600 mg-ı aşan dozlar önerilmez.
- Kan Sayımı İzlemi:
- Tam kan sayımı, tedavinin ilk ayında haftalık olarak, ikinci ayda iki haftada bir ve ardından düzenli aralıklarla yapılmalıdır.
- İlaç yemekle birlikte ve büyük bir bardak suyla alınmalıdır:
- Bu, mide-bağırsak tahrişi riskini azaltır. Tabletler, yutma zorluğu çeken hastalar için su veya elma suyunda çözülebilir.
- Hematolojik Yanıtlar:
- Hematolojik yanıtlar genellikle tedavi başlangıcından sonraki 2 hafta içinde gözlenir ve tam hematolojik yanıt 4 hafta içinde elde edilir. Sitogenetik yanıtlar, tedaviye başladıktan sonra 2 ila 10 ay içinde gözlenebilir. En iyi sitogenetik yanıtın medyan süresi yaklaşık 5 aydır.
- Fenitoin ve Diğer CYP3A4 İndükleyicileri:
- Fenitoin ve diğer CYP3A4 enzim indükleyicileri (karbamazepin, rifampin, fenobarbital ve St. John’s Wort gibi), imatinib metabolizmasını artırarak ilacın etkinliğini azaltabilir. Bu durumda imatinib dozunun artırılması gerekebilir.
- Warfarin Kullanımı:
- İmatinib, karaciğer P450 sistemi yoluyla warfarin metabolizmasını inhibe edebilir. Bu, protrombin zamanı (PT) ve uluslararası normalize oranında (INR) değişikliklere veya kanama riskinde artışa yol açabilir. Warfarin kullanan hastalar pıhtılaşma parametreleri açısından yakından izlenmelidir. Gerekirse, antikoagülasyon için düşük moleküler ağırlıklı veya standart heparin kullanılmalıdır.
- Kalp Fonksiyonlarının İzlenmesi:
- Tedavi öncesinde ve tedavi sırasında kalp fonksiyonları (MUGA, Radyonüklid Ventrikülografi) taraması veya ekokardiyografi ile izlenmelidir. Ödem gelişen hastalarda konjestif kalp yetmezliği (KKY) olasılığı dikkate alınmalıdır.
- Greyfurt ve Benzeri Gıdalar:
- Greyfurt suyu, Seville portakalı, yıldız meyvesi ve pomelo gibi ürünlerden kaçınılmalıdır. Bu gıdalar, CYP3A4 enzimini inhibe ederek ilaç düzeylerinin artmasına neden olabilir.
- Hastalar depresyon belirtileri ve intihar düşünceleri açısından izlenmelidir:
- İmatinib tedavisi sırasında bu tür psikolojik durum değişiklikleri ortaya çıkabilir.
- Kas ve İskelet Ağrıları:
- İmatinib tedavisini uzun süre kullanan ve tedaviyi bırakan hastalarda kas ve iskelet ağrıları gelişebilir. Bu ağrılar genellikle omuz, kalça, ekstremiteler ve eller/ayaklarda hissedilir.
- Kan Basıncı ve Kalp Atış Hızı İzlemi:
- Tedavinin ilk yılında, hastaların kan basıncı ve kalp atış hızı aylık olarak izlenmelidir.
- Hepatit B İzlemi:
- Tedaviye başlamadan önce tüm hastalar Hepatit B (HBV) enfeksiyonu açısından taranmalıdır. HBV taşıyıcıları, tedavi sırasında aktif enfeksiyon belirtileri açısından izlenmelidir. HBV reaktivasyonu gelişirse, imatinib tedavisi kalıcı olarak durdurulmalıdır.
- Gebelik:
- İmatinib, gebelik kategorisi D olarak sınıflandırılmıştır. Bu, ilacın gebelik sırasında kullanımının fetüse zarar verme potansiyeli taşıdığı anlamına gelir. Gebelik sırasında kullanımı önerilmez. Ayrıca, emzirme de önerilmez. Doğurganlık çağındaki kadınların tedavi sırasında etkili bir doğum kontrol yöntemi kullanmaları gereklidir.
Yan Etkiler
- Bulantı ve Kusma (%40–50):
- Hastaların %40-50-sinde görülür. Genellikle kapsüllerin yutulması ile ilişkilidir ve yemekle birlikte alındığında azalır.
- Geçici Ayak Bileği ve Periorbital Ödem:
- Hafif ila orta derecede görülür.
- Zaman Zaman Gözlenen Miyalji:
- Kas ağrıları hastaların bir kısmında ortaya çıkabilir.
- Sıvı Tutulumu:
- Plevral efüzyon, asit, pulmoner ödem ve kilo artışı gibi belirtilerle birlikte sıvı tutulumu görülebilir. Bu durum genellikle doz ile ilişkilidir ve ileri yaştaki veya blast krizindeki KML hastalarında daha sık görülür. Konjestif kalp yetmezliği (KKY) nadir ancak ciddi bir advers olaydır.
- Diyare (%25–30):
- Hastaların yaklaşık dörtte birinde görülür.
- Kemik İliği Baskılanması:
- Nötropeni ve trombositopeni gibi durumlarla karakterizedir.
- Serum Transaminazlarında Hafif, Geçici Yükselme:
- Çoğu durumda klinik olarak asemptomatiktir.
- Deri Toksisitesi:
- Eritema multiforme ve Stevens-Johnson sendromu gibi büllöz reaksiyonlar gözlenebilir.
- Uyku Bozuklukları, Depresyon ve İntihar Düşünceleri:
- Bazı hastalarda insomnia, depresyon ve intihar düşünceleri bildirilmiştir.






