İntrahepatik Kolanjiokarsinom için Futibatinib Hızlandırılmış FDA Onayı Aldı
Daha önce tedavi almış, ameliyatla çıkarılamayan, bölgesel olarak ilerlemiş veya metastatik, fibroblast büyüme faktörü reseptörü 2 (FGFR2) gen mutasyonu pozitif intrahepatik kolanjiokarsinomu olan yetişkin hastalar için futibatinib (Lytgobi, Taiho Oncology, Inc.), 30 Eylül 2022'de hızlandırılmış FDA onayı aldı.
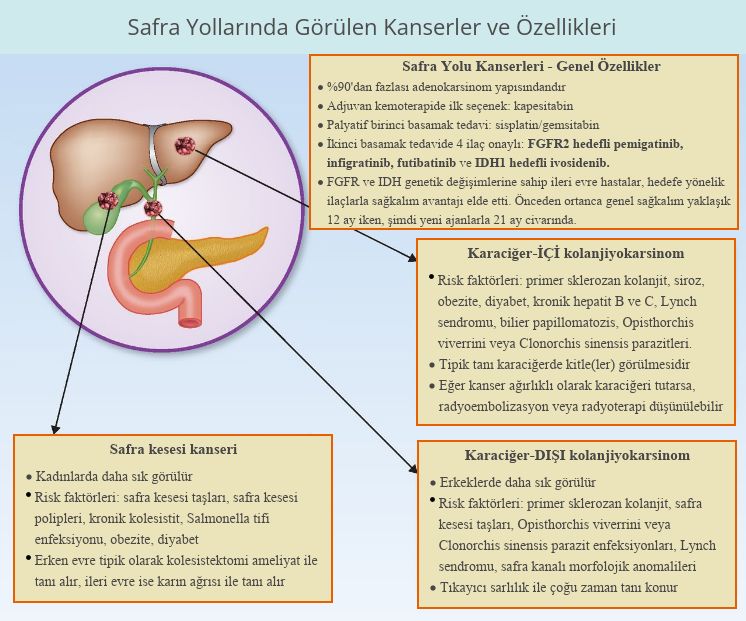
Safra yolları kanserlerine tıp dilinde kolanjiokarsinom diyoruz. Tanı sırasında kolanjiyokarsinomlu hastaların çoğu ileri evrededir, bu da hastalığın artık ameliyatla tedavi edilemeyeceği anlamına gelir. Bu hastalar için kemoterapi ilaçlarının bir kombinasyonu standart başlangıç tedavisi olmuştur. Kolanjiyokarsinomlu hastaların yaklaşık % 9 ila % 14'ünün tümörlerinde FGFR2 genetik değişimleri (örneğin füzyonlar) bulunmuştur. Futibatinib, kolanjiokanserde FGFR2 hedefli FDA onayı alan 3. akıllı ilaç oldu. Daha önce Mayıs 2021'de infigratinib ve Nisan 2020'de pemigatinib bu endikasyon için FDA onayı almıştı.
Futibatinibin etkinliği, bir FGFR2 gen füzyonu veya başka bir yeniden düzenleme barındıran daha önce tedavi edilmiş, ameliyatla tümörü çıkarılamayan, bölgesel olarak ilerlemiş veya metastatik intrahepatik kolanjiokarsinomu olan 103 hastayı içeren çok merkezli, açık etiketli, tek kollu bir deneme olan TAS-120-101'de değerlendirildi. FGFR2 füzyonlarının veya diğer yeniden düzenlemelerin varlığı, yeni nesil dizileme genetik testi (NGS) kullanılarak belirlendi. Hastalar, hastalık ilerlemesine veya kabul edilemez yan etkiye kadar günde bir kez 20 mg futibatinib aldı.
Başlıca etkililik sonuç ölçütleri, bağımsız bir inceleme komitesi tarafından belirlenen genel yanıt oranı ve yanıt süresi idi.
- Genel yanıt oranı %42 idi (%95 Güven Aralığı [CI]: 32, 52)
- Tedaviye yanıt veren 43 hastanın tümünde kısmi yanıtlar elde edildi.
- Ortanca yanıt süresi 9.7 aydı (%95 GA: 7.6, 17.1).
Hastaların %20 veya daha fazlasında meydana gelen en yaygın yan etkiler tırnak toksisitesi, kas-iskelet ağrısı, kabızlık, ishal, yorgunluk, ağız kuruluğu, saç dökülmesi, stomatit (ağız yarası), karın ağrısı, kuru cilt, artralji (eklem ağrısı), tat alma bozukluğu, kuru göz, bulantı, iştah azalması, idrar yolu enfeksiyonu, palmar-plantar eritrodisestezi sendromu ve kusma idi.
Önerilen futibatinib dozu, hastalık ilerlemesi veya kabul edilemez yan etki oluşana kadar oral olarak günde bir kez 20 mg'dır.
FDA grants accelerated approval to futibatinib for cholangiocarcinoma. fda.gov 30 Sep 2022






