Kolanjiokanserde (safra yolu kanseri) FGFR2 hedefli 2. ilaç FDA onayı aldı: infigratinib
Daha önce tedavi almış, tümörü bölgesel olarak yayıldığı için ameliyat edilemeyen veya metastatik kolanjiokarsinomu (safra yolu kanseri) olan ve fibroblast büyüme faktörü reseptörü 2 (FGFR2) genetik değişimine sahip yetişkinler için bir kinaz inhibitörü olan infigratinib (Truseltiq, QED Therapeutics, Inc.) adlı ilaca, 28 Mayıs 2021'de FDA (ABD Gıda ve İlaç İdaresi) hızlandırılmış onay verdi.
İnfigratinib, FGFR2 mutasyonu pozitif kolanjiokarsinom için FDA onayı alan 2. ilaç oldu. Daha önce pemigatinib, 17 Nisan 2020'de FDA onayı almıştı.
FDA ayrıca, FGFR2 gen füzyonu veya diğer yeniden düzenlemesi olan hastaların seçimi için FoundationOne® CDx'i (Foundation Medicine, Inc.) infigratinib tedavisi için eşlik eden bir genetik test olarak onayladı.
Güncelleme: FDA Onayı Geri Çekti (21.05.2024)
FDA, belirli tipte daha önce tedavi edilmiş kolanjiokarsinomu olan hastalar için 2021'de verdiği infigratinib (Truseltiq) hızlandırılmış onayını geri çektiğini açıkladı.
İnfigratinib, başlangıçta Mayıs 2021'de, ameliyat edilemeyen lokal ileri veya metastatik kolanjiokarsinomu ve fibroblast büyüme faktörü reseptörü 2 (FGFR2) füzyonu veya başka bir yeniden düzenlemesi olan yetişkinlerin tedavisi için hızlandırılmış onay almıştı. Bu onay, üretici firma QED Therapeutics, Inc.'in, ilacın klinik faydasını doğrulayıcı denemelerle kanıtlaması şartına bağlıydı.
Onay, sponsorun talebi üzerine gönüllü olarak geri çekildi. FDA güncellemesine göre, "gerekli doğrulayıcı klinik çalışma için çalışma konularını işe alma ve kaydetmede yaşanan zorluklar" nedeniyle onay geri çekildi. Doğrulayıcı klinik çalışma, yeni bir endikasyon altında ilacın birinci basamak tedavideki etkinliğini araştırıyordu. QED, işe alım ve kayıttaki zorluklar nedeniyle, ilacın kolanjiokarsinomu için ikinci basamak tedavideki (hızlandırılmış onay endikasyonu) dağıtımının "ticari olarak makul olmadığını" belirledi. Ancak, QED'e göre, ajan diğer FGFR odaklı koşullar için incelenmeye devam ediyor.
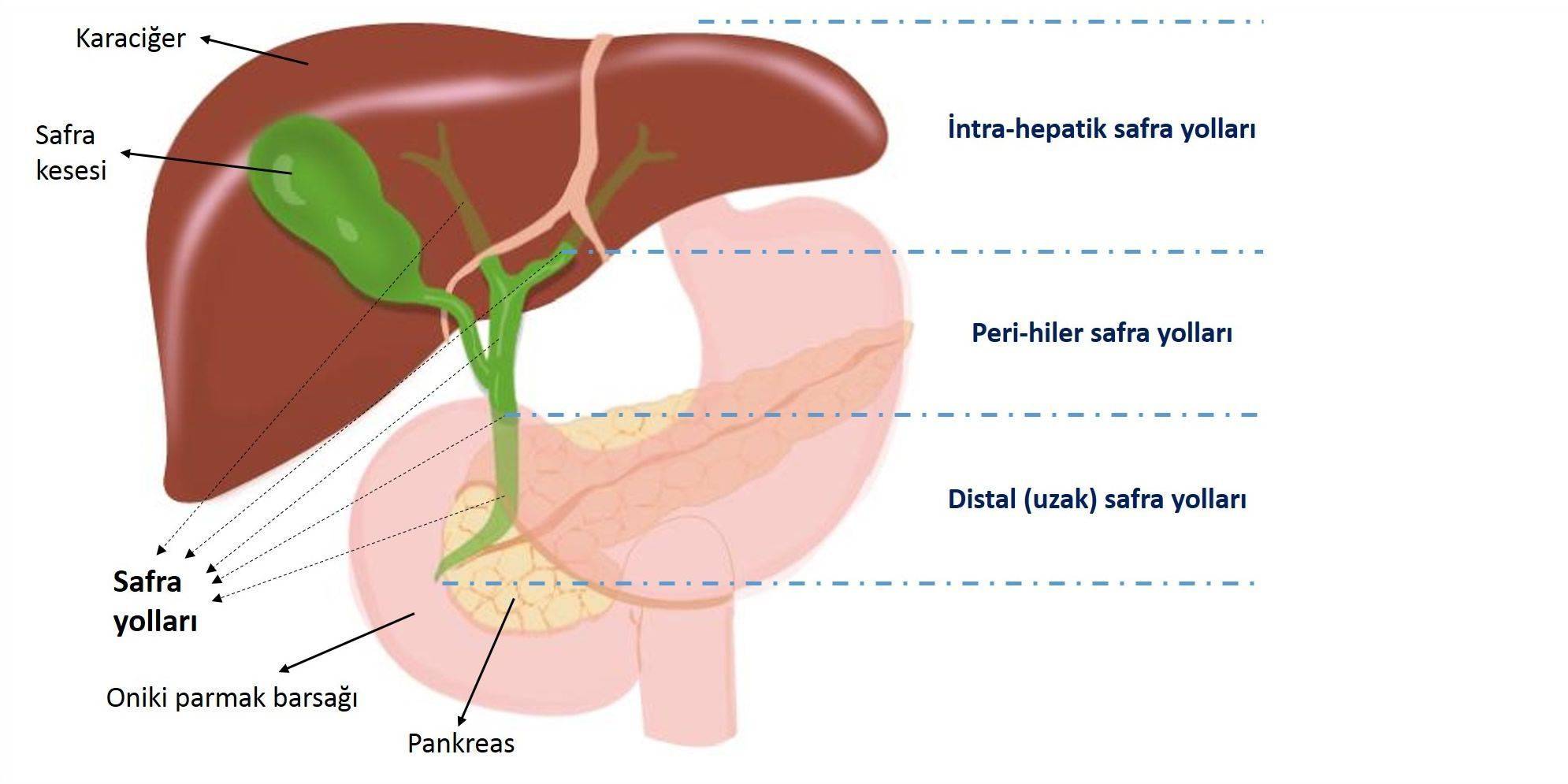
Aşağıda, safra yolları kanserlerinin anatomik gölgelerine göre sınıflaması görülebilir.
Kolanjiokarsinomda tetikleyici mutasyonlar
Kolanjiyokarsinomun yönetimi, ortaya çıkan yeni hassas ilaç stratejileri ile hızla değişmektedir. Bu kanser türündeki çoğu araştırma, intrahepatik kolanjiokarsinomalı (karaciğer içi safra yolu kanserli) hastaların yaklaşık % 40'ında bulunabilen fibroblast büyüme faktörü reseptörü-2 (FGFR2) füzyonları ve izositrat dehidrogenaz-1 (IDH1) mutasyonları barındıran hastalara odaklanmaktadır.
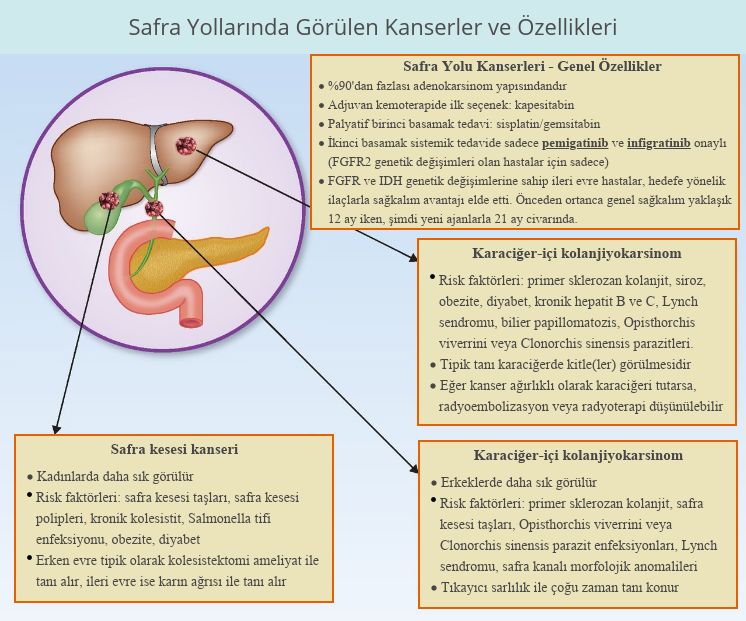
Aşağıda, kolanjiokanserlerin klinik ve genetik özellikleri özet olarak sunulmuştur.
CBGJ398X2204 çalışması ile gelen FDA onayı
İnfigratinib, FGFR2 füzyonu veya yeniden düzenlenmesi olan ve daha önce tedavi almış, rezeke edilemeyen lokal ileri veya metastatik kolanjiokarsinomlu 108 hastayı içeren çok merkezli açık etiketli tek kollu bir deneme olan CBGJ398X2204'te (NCT02150967) etkinlik gösterilmiştir.
Hastalar, art arda 21 gün boyunca günde bir kez 125 mg infigratinib aldı ve ardından tedaviye 7 gün ara verildi. Bu şekilde 28 günlük her bir döngü 1 kür kabul edildi ve tedavi, hastalık progresyonuna veya kabul edilemez toksisiteye kadar devam etti.
Sonuçlar
Başlıca etkililik sonuç ölçütleri, RECIST 1.1'e göre kör bağımsız merkezi inceleme ile belirlendiği üzere genel yanıt oranı ve yanıt süresi idi.
- İnfigratinib için genel yanıt oranı, 1 tam yanıt ve 24 kısmi yanıt ile %23'tü (%95 GA: 16, 32).
- Ortanca yanıt süresi 5 aydı (%95 GA: 3.7, 9.3).
- 23 yanıt verenden 8 hasta yanıtı 6 ay veya daha uzun süre korumuştur.
En yaygın (sıklık ≥ %20) yan etkiler hiperfosfatemi, kreatinin artışı, tırnak toksisitesi, stomatit, kuru göz, yorgunluk, alopesi, palmar-plantar eritrodisestezi sendromu, artralji, disguzi, kabızlık, karın ağrısı, ağız kuruluğu, kirpik değişiklikleri, ishal, kuru cilt, iştah azalması, bulanık görme ve kusma olarak bildirildi. Ciddi riskler hiperfosfatemi ve retina pigment epitel dekolmanını içerir ve tedavi sırasında bu advers reaksiyonların izlenmesi önerilir.
Önerilen infigratinib dozu, ardışık 21 gün boyunca aç karnına günde bir kez 125 mg'dır.
*
FDA grants accelerated approval to infigratinib for metastatic cholangiocarcinoma. fda.gov 28 May 2021