HER2 Pozitif İleri Evre Safra Yolları Kanserinde Zanidatamab
Gelişen teknoloji ve medikal bilgi birikimi ile birlikte kanser tedavilerindeki hedefe yönelik yaklaşımlar daha fazla önem kazanmıştır. Hedefe yönelik tedaviler, hastalıkların özgül biyolojik özelliklerini hedef alarak hastaların yaşam kalitesini ve sağkalım oranlarını artırabilirler. Bu makalede, HER2 pozitif ileri evre safra kanalı kanseri olan hastalarda yeni bir tedavi seçeneği olan zanidatamabın etkinliğini ve güvenilirliğini araştıran bir çalışma ele alınmaktadır. Safra kanalı/yolları kanseri, özellikle ileri aşamalarında tedavi edilmesi zor bir hastalıktır ve bu yüzden yeni ve daha etkin tedavi yöntemlerine ihtiyaç vardır.
HER2 (Human Epidermal Growth Factor Receptor 2), birçok kanser türünde hücre büyümesini ve bölünmesini uyarabilen bir reseptördür. HER2'nin aşırı ifadesi veya gen düzeyinde amplifikasyonu (genin DNA'da kopya sayısının artması), çeşitli kanser türlerinde, özellikle meme ve mide kanserlerinde görülür.
Safra kanalı kanserlerinde HER2 pozitifliği daha az yaygındır, ancak buna rağmen belirli bir hasta grubunda görülür. Karaciğer dışı safra yolu kanserlerinde HER2 mutasyonları veya gen amplifikasyonları %17.4 - %18.5 oranında, safra kesesi kanserlerinde %19.1 - %31.3 oranında ve karaciğer içi safra yolu kanserlerinde ise %3.7 - %4.8 oranında görülür.
Bu oranlar, safra kanalı kanserlerinde HER2 hedefli tedavilerin potansiyel uygulanabilirliğini gösterir.
Safra Kanalı Kanseride Bir HER2 Hedefli Ajanın En Büyük Faz-2 Araştırması
Lancet Oncology'de yayımlanan HERIZON-BTC-01 adlı faz IIb çalışması, safra kanalı kanseri olan hastalarda bir HER2 hedefli ajanın en büyük faz 2 denemesidir. Dr. James J. Harding ve meslektaşları, zanidatamab adlı ilacın, daha önce tedavi görmüş HER2 pozitif ileri evre safra kanalı kanseri olan hastalarda etkili olduğunu buldular.
Zanidatamab Etki Mekanizması Nasıldır?
Zanidatamab, insan epidermal büyüme faktörü reseptörü 2'yi (HER2) hedefleyen bir bi-spesifik antikordur. Bi-spesifik antikorlar, iki farklı hedefi eşzamanlı olarak tanıma yeteneğine sahiptir. Zanidatamab, hedef olarak seçtiği HER2 reseptörü üzerinde iki farklı antijen bağlama alanına bağlanır: HER2'nin dimerizasyon alanı ve ekstraselüler juxtamembran alanı.
Bu özel yapısı, zanidatamabın HER2 molekülleri arasında çapraz bağlantılar oluşturmasına ve reseptörlerin hücre yüzeyinde kümelenmesine yardımcı olur. Bu durum, reseptörlerin hücre içine alınmasını ve HER2 sinyal yolunun aktivitesinin azaltılmasını sağlar. Bu süreç, kanser hücrelerinin büyümesini ve çoğalmasını kontrol altına alır çünkü HER2, bazı kanser türlerinde hücre büyümesini ve bölünmesini uyarır.

Zanidatamab ayrıca, Antibody Dependent Cellular Cytotoxicity (ADCC), Antibody Dependent Cellular Phagocytosis (ADCP) ve Complement Dependent Cytotoxicity (CDC) adı verilen immün sistem mekanizmalarını da aktive eder.
ADCC, antikorların hedef hücreleri özel hücreler (örneğin, doğal öldürücü hücreler) aracılığıyla öldürme yeteneğini ifade eder. Zanidatamab, hedef hücrelerin (bu durumda HER2'nin aşırı ifade edildiği kanser hücreleri) öldürülmesi için immün sistemin doğal öldürücü hücrelerini yönlendirir. ADCP, antikorların hedef hücreleri, genellikle makrofajlar ve dendritik hücreler gibi hücreleri yutma yeteneğini ifade eder. CDC, antikorların, tamamlayıcı sistemin bir parçası olan özel proteinler aracılığıyla hedef hücreleri öldürme yeteneğini ifade eder.
Ön klinik çalışmalarda, zanidatamab, tek başına trastuzumab tedavisine veya trastuzumab ve pertuzumab kombinasyonuna göre daha üstün anti-tümör aktivite göstermiştir. Bu nedenle, zanidatamab, HER2 pozitif kanserlerin tedavisinde potansiyel bir adaydır.
Klinik Araştırmanın Detayları
Çalışmada, gemsitabin-bazlı kemoterapi ile ilerleme gösteren bölgesel olarak ilerlemiş veya metastatik safra yolu kanseri olan 87 hasta Kanada, Şili, Çin, Fransa, İtalya, Güney Kore, İspanya, Birleşik Krallık ve Amerika Birleşik Devletleri'nden dahil edildi.
Hastalar, HER2 immünohistokimya (IHC) skorlarına göre iki gruba ayrıldı:
- grup 1 (80 hasta; IHK 2+ veya 3+ = HER2 pozitif) ve
- grup 2 (n = 7 hasta; IHK 0 veya 1+).
Grup 1'deki hastaların %65'i Asyalıydı ve %89'unda kanser 4. evrede idi. HER2 IHK 0 veya 1+ ile tümörü olan hasta sayısı beklenenden düşük olduğu için, grup 1 tamamen kayıt edildiğinde grup 2'ye kayıt durduruldu. Hastalar 2 haftada bir 20 mg/kg zanidatamab aldılar.
Grup 1'deki hastaların;
- %51'i safra kesesi kanseri,
- %29'u karaciğer içi safra yolları kanseri (intrahepatik kolanjiokarsinom) ve
- %20'si karaciğer dışı safra yolları kanseri (ekstrahepatik kolanjiokarsinom) hastası idi.
Çalışmanın birincil sonlanım noktası, bağımsız merkezi inceleme ile değerlendirilen grup 1'deki doğrulanmış objektif yanıt oranıydı.
Yanıtlar
- Ekim 2022'deki veri kesiminde, ortanca takip süresi 12.4 aydı (çeyrekler açıklığı = 9.4–17.2 ay).
- Grup 1'deki
- 80 hastanın 33'ünde (%41.3, %95 güven aralığı [CI] = %30.4–%52.8) objektif yanıt gözlendi; bunlardan 1'inde (%1.3) tam yanıt görüldü.
- Ek olarak, 22 hasta (%27.5) stabil hastalık gösterdi,
- Bu veriler sonuç olarak %68.8'lik bir hastalık kontrol oranı demektir.
- Tedaviye yanıt veren hastalarda ortanca yanıt süresi 12.9 aydı (%95 CI = 6.0 aydan tahmin edilemez), veri kesim zamanında 16 yanıt (%49) devam ediyordu.
- Ortanca progresyonsuz sağkalım 5.5 aydı (%95 CI = 3.7–7.2 ay).
- Genel sağkalım verileri olgunlaşmamıştı, ancak 9 aylık genel sağkalım oranı %69.9 (%95 CI = %57.8–%79.1) idi.
Grup 2'deki yedi hastada objektif yanıtlar gözlemlenmedi. Ortanca progresyonsuz sağkalım 1.9 aydı (%95 CI = 1.2 aydan tahmin edilemez), ve ortanca genel sağkalım 5.5 aydı (%95 CI = 1.2–10.1 ay).
Aşağıda, çalışmanın alt grup analizi görülebilir:
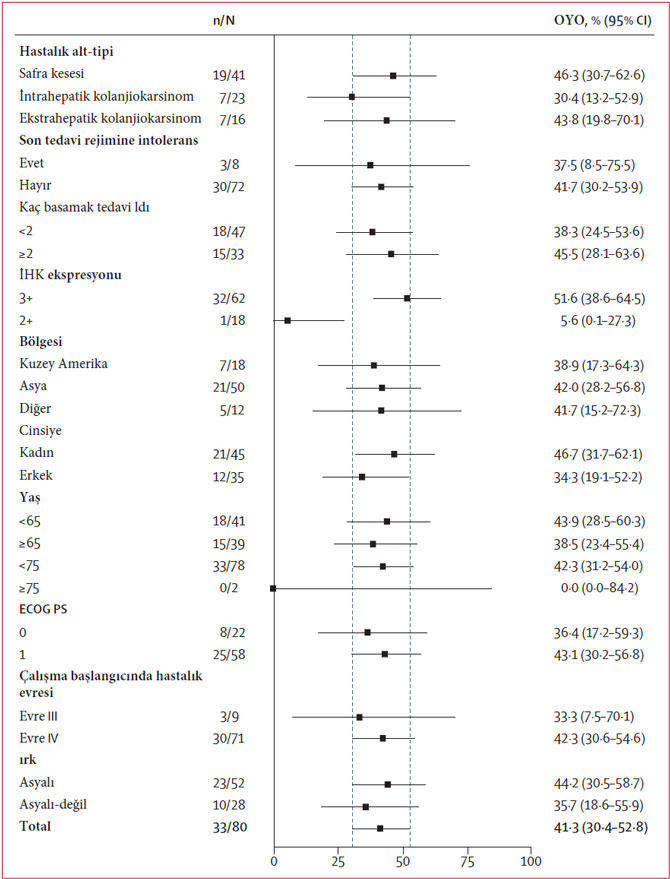
Figür 1. Grup 1'deki (HER2-pozitif) alt gruplara göre bağımsız merkezi inceleme tarafından belirlenen objektif yanıt oranı (OYO). Referans çizgileri genel grubun %95 CI sınırlarını gösterir. ECOG PS=Eastern Cooperative Oncology Group performans durumu. IHK=immunohistokimya. OYO=objektif yanıt oranı.
Yan Etkiler
87 hastanın tümünde, herhangi bir derecede en yaygın tedaviye bağlı yan etkiler ishal (%37), infüzyona bağlı reaksiyonlar (%33), azalmış ejeksiyon fraksiyonu (%9, kalp kasılma gücünde azalma) ve bulantı (%9) idi. Tedaviye bağlı derece 3 yan etkiler (derece 4 veya 5 olay gözlemlenmedi) 16 hastada (%18) meydana geldi, en yaygınları ishal (%5) ve azalmış ejeksiyon fraksiyonu (%3) idi. Herhangi bir derecede ciddi tedaviye bağlı yan etkiler %8 oranında hastada meydana geldi. Tedaviye bağlı yan etkiler, iki hastada tedavi kesilmesine neden oldu; bunlar azalmış ejeksiyon fraksiyonu ve pnömonitis idi.
Yorum
Bu faz 2 tek kolu çalışma, zanidatamabın HER2-pozitif safra kanalı kanseri olan hastaların tedavisindeki anti-tümör aktivitesini ve güvenliğini değerlendirdi. İleri evre safra kanalı kanseri, kötü bir hastalık gidişatına sahip olduğu bilinen bir hasta grubunu temsil etmektedir. Bu moleküler alt grup için onaylanmış HER2 hedefli tedaviler bulunmamaktadır ve bu nedenle önemli bir tıbbi ihtiyaç bulunmaktadır. Bu çalışmanın sonuçları, zanidatamabın iyi tolere edildiğini ve yanıt oranı ve yanıt süresi açısından cesaret verici tek ajan aktivitesi olduğunu gösterdi. Bu, safra kanalı kanseri olan hastalarda bir HER2 hedefli ajanın en büyük faz 2 denemesidir.
Çalışmanın sonuçları, zanidatamabın, HER2 açısında 2+ veya 3+ olduğu belirlenen ileri evre safra kanalı kanseri olan hastalar için potansiyel bir tedavi olabileceğini desteklemektedir. Bu sonuçlara dayanarak, zanidatamabın, birinci basamak kemoterapiyle kombinasyon halinde ve ileri evre safra kanalı kanseri için monoterapi tedavi seçeneği olarak klinik çalışmalarda kullanılması için çabalar devam etmektedir.
James J Harding, Jia Fan, Do-Youn Oh, Hye Jin Choi, Jin Won Kim, Heung-Moon Chang, et al. Zanidatamab for HER2-amplified, unresectable, locally advanced or metastatic biliary tract cancer (HERIZON-BTC-01): a multicentre, single-arm, phase 2b study. THE LANCET Oncology. 02 June 2023